Il trapianto di fegato, effettuato nell’uomo per la prima volta circa 60 anni fa, rappresenta la cura per i pazienti con cirrosi epatica scompensata o complicata da epatocarcinoma.
Un lavoro recentemente pubblicato (1) riporta come nel 2017 le morti globali attribuibili alla cirrosi rappresentino il 2.4%, contro il 1.9% del 1990. Inoltre nel 2017, il 31.5% delle morti per cirrosi nei maschi erano attribuibili al virus dell’epatite B (HBV), 25.5% al virus dell’epatite C (HCV), il 27.3% all’epatopatia alcol correlata ed il 7.7% alle steatoepatite non alcolica (MASLD). Le donne rispetto ai maschi, avevano una più alta percentuale di cirrosi da MASLD (11.3%), e minore da HBV (24%).
Stanno, peraltro, emergendo nuove indicazioni al trapianto di fegato come le metastasi epatiche da tumori del colon retto, il colangiocarcinoma, le metastasi da tumore neuroendocrino... e la richiesta di trapianto epatico eccede persistentemente la disponibilità di organi. Nel 2021, nel mondo si sono effettuati 34.694 trapianti di fegato, 6.5% in più rispetto al 2020 e 20% in più rispetto al 2015. L’uso dei donatori viventi, dei donatori in morte cardiaca e di donatori sub-ottimali hanno consentito di espandere il pool di organi utilizzabili. Sebbene il donatore cadavere rappresenti più del 90% dei trapianti nei paesi occidentali, in molti paesi asiatici la maggior parte dei trapianti sono effettuati da donatori viventi (2).
L’eziologia della cirrosi necessitante il trapianto varia a seconda delle aree del mondo. Nonostante i progressi fatti nel trattamento dell’epatite virale HBV e HCV, le epatiti virali sono la principale causa di cirrosi e carcinoma epatocellulare nel sud-est asiatico, in Africa e nelle zone dell’est del Mediterraneo. Negli Stati Uniti di America e in Europa, si è assistito, per contro, ad un importante declino dell’epatite C come indicazione a trapianto a partire dal 2014, anno in cui si sono resi disponibili gli antivirali ad azione diretta (DAA). Attualmente l’epatopatia alcolica rappresenta la principale indicazione a trapianto di fegato in Europa e in America (3,4).
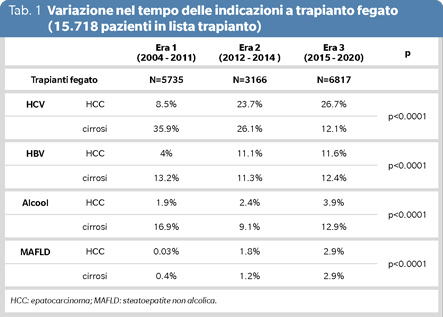 Uno studio italiano recentemente pubblicato (5) ha raccolto i trapianti di fegato in Italia dal 2004 al 2020, dividendoli in tre ere: 2004-2011: Era 1; 2012-2014: Era 2; 2015-2020: Era 3. I pazienti in lista trapianto per cirrosi scompensata si sono ridotti dal 65% in Era 1 al 46.1% in Era 3, mentre i pazienti affetti da epatocarcinoma sono aumentati dal 28.7% al 48.7%. Paragonando l’Era 1 con la 3, i pazienti in attesa di trapianto per epatopatia HCV relata si sono ridotti dal 35.9% al 12.1%, mentre quelli in attesa per epatocarcinoma HCV-relato sono aumentati dal 8.5% al 26.7% (Tabella 1). I pazienti in attesa per cirrosi HBV sono rimasti, per contro, pressoché stabili (13.2% e 12.4%), mentre l’epatocarcinoma correlato ad HBV è aumentato dal 4% al 11.6%.
Uno studio italiano recentemente pubblicato (5) ha raccolto i trapianti di fegato in Italia dal 2004 al 2020, dividendoli in tre ere: 2004-2011: Era 1; 2012-2014: Era 2; 2015-2020: Era 3. I pazienti in lista trapianto per cirrosi scompensata si sono ridotti dal 65% in Era 1 al 46.1% in Era 3, mentre i pazienti affetti da epatocarcinoma sono aumentati dal 28.7% al 48.7%. Paragonando l’Era 1 con la 3, i pazienti in attesa di trapianto per epatopatia HCV relata si sono ridotti dal 35.9% al 12.1%, mentre quelli in attesa per epatocarcinoma HCV-relato sono aumentati dal 8.5% al 26.7% (Tabella 1). I pazienti in attesa per cirrosi HBV sono rimasti, per contro, pressoché stabili (13.2% e 12.4%), mentre l’epatocarcinoma correlato ad HBV è aumentato dal 4% al 11.6%.
Focalizzando la nostra attenzione sull’epatopatia delta, dal 1988 al 2016, 7761 trapianti sono stati inseriti sul Registro Europeo; 5822 (75%) attribuibili alla monoinfezione HBV e 1939 (25%) alla coinfezione HDV, con un rapporto HBV versus HBV/HDV di 3:1. Negli ultimi 15 anni, il numero di trapianti da epatopatia HBV inseriti nel registro si è quasi dimezzato (3826), mentre quelli da HBV/HDV si sono ridotti a 1431, ossia di un quarto, con un rapporto di HBV versus HBV/HDV di 2.7 a 1.
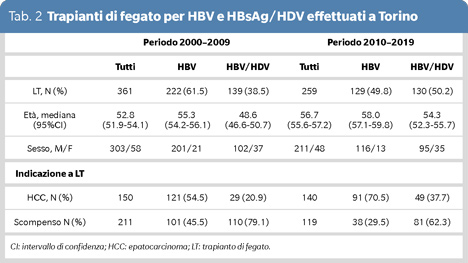 Nel centro trapianti di Torino, di 361 pazienti HBsAg-positivi trapiantati tra il 2000-2009 139 (38.5%) erano coinfetti HDV, versus 130/259 (50.2%) della decade 2010-2019 (Tabella 2). In considerazione della riduzione percentuale di HDV in Europa, grazie alla diffusione della vaccinazione anti-HBV, la persistenza di una coorte di pazienti che sta invecchiando con cirrosi da infezione HDV, acquisita molte decadi fa, continua ad impattare significativamente sul programma trapianto. La sproporzione numerica di trapianti HDV versus HBV deriva anche dall’efficacia degli antivirali anti-HBV, mentre la scarsa efficacia dell’interferone non ha impedito negli anni scorsi la progressione della cirrosi HDV nei pazienti affetti dalla coinfezione. Inoltre, analogamente a quanto successo in America, a Torino nell’ultima decade, 62.3% dei pazienti HDV sono stati trapiantati per scompenso epatico e 37.7% per epatocarcinoma, mentre solo il 29.5% dei pazienti HBV sono stati trapiantati per scompenso e 70.5% per epatocarcinoma, il cui sviluppo non può essere del tutto contrastato dalla attuali terapia in uso (6).
Nel centro trapianti di Torino, di 361 pazienti HBsAg-positivi trapiantati tra il 2000-2009 139 (38.5%) erano coinfetti HDV, versus 130/259 (50.2%) della decade 2010-2019 (Tabella 2). In considerazione della riduzione percentuale di HDV in Europa, grazie alla diffusione della vaccinazione anti-HBV, la persistenza di una coorte di pazienti che sta invecchiando con cirrosi da infezione HDV, acquisita molte decadi fa, continua ad impattare significativamente sul programma trapianto. La sproporzione numerica di trapianti HDV versus HBV deriva anche dall’efficacia degli antivirali anti-HBV, mentre la scarsa efficacia dell’interferone non ha impedito negli anni scorsi la progressione della cirrosi HDV nei pazienti affetti dalla coinfezione. Inoltre, analogamente a quanto successo in America, a Torino nell’ultima decade, 62.3% dei pazienti HDV sono stati trapiantati per scompenso epatico e 37.7% per epatocarcinoma, mentre solo il 29.5% dei pazienti HBV sono stati trapiantati per scompenso e 70.5% per epatocarcinoma, il cui sviluppo non può essere del tutto contrastato dalla attuali terapia in uso (6).
Nel post-trapianto di fegato per epatite HBV, la terapia di comune impiego finalizzata ad impedire la reinfezione dell’organo, consiste nella combinazione di un antivirale ad azione diretta di terza generazione (entecavir o tenofovir) + immunoglobuline anti-HBV; tuttavia casistiche americane e europee hanno dimostrato come nei pazienti che giungono al trapianto negativi per HBV DNA, la monoterapia con antivirali di terza generazione, con o senza un periodo di immunoglobuline post-trapianto, sia ampiamente protettiva sulla recidiva HBV (7). Dati sulla sicurezza della monoterapia con i soli antivirali stanno emergendo anche nei coinfetti HBV/HDV, un tempo impropriamente ritenuti a più alto rischio di recidiva virale (8).
Per quanto concerne HCV, ad oggi la maggioranza dei pazienti giunge alla lista trapianto eradicata dal virus con i DAA e la piccola percentuale di pazienti ancora HCV viremica viene trattata precocemente post-trapianto, con percentuali di successo intorno al 99%, al fine di preservare la funzionalità dell’organo trapiantato. Nei pazienti che giungono invece viremici al trapianto in quanto relapser agli inibitori di NS5A (es velpatasvir), si ricorre all’uso di sofosbuvir/velpatasvir/voxilaprevir post-trapianto. A Torino da gennaio 2019 a marzo 2022, di 490 trapianti di fegato, 49 (10%) sono stati eseguiti in pazienti viremici, di cui 43 naive a DAA e 6 relapser agli inibitori di NS5A. Nei naive alla terapia, il tempo mediano di inizio dei DAA rispetto al trapianto è stato di 1 giorno, mentre nei relapser ai NS5A è stato di 14.5 giorni, in considerazione della possibile epatotossicità da inibitori delle proteasi, ottenendo un tasso di eradicazione virale del 98% (9).
I pazienti che giungono ancora viremici al trapianto possono peraltro accedere, in via preferenziale, ad un organo HCV viremico, che in alternativa è allocabile ad un paziente naive, curando l’epatite del donatore nel ricevente, iniziando i DAA il più precocemente possibile post-trapianto ed ottenendo anche la regressione della fibrosi eventualmente presente al momento della donazione (10). L’allocazione di un organo HCV viremico a un ricevente non viremico consente di raggiungere sopravvivenze di organo e paziente confrontabili con quelle dei pazienti HCV negativi che ricevono un organo non viremico (2). Gli organi HbsAg positivi vengono invece preferenzialmente allocati ai riceventi HBsAg positivi (purché siano HDV negativi), e la profilassi post-trapianto si basa unicamente sugli antivirali di III generazione (entecavir o tenofovir), mentre le immunoglobuline anti-HBV sono superflue non riuscendo a neutralizzare la ricomparsa dell’HBsAg (2).
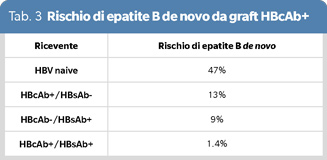 Trapiantare invece un organo HBcAb positivo in un ricevente HBsAg positivo rappresenta la miglior allocazione in quanto il ricevente HBsAg positivo necessita di per sé, per tutta la vita, di una profilassi, al fine di prevenire la reinfezione dell’organo. I soggetti HBV-naive, ricevendo un organo HBcAb sono a più alto rischio di infezione de novo (47%), seguiti dai riceventi HBcAb+/HBsAb- (13%) e dagli HBcAb-/HBsAb+ (9%) e tali riceventi vengono pertanto trattati long-term con lamivudina o antivirali di generazioni successive; per contro i soggetti HBcAb+/HBsAb+ hanno un rischio bassissimo di nuova infezione (1.4%) ricevendo un organo HBcAb positivo (11), (Tabella 3).
Trapiantare invece un organo HBcAb positivo in un ricevente HBsAg positivo rappresenta la miglior allocazione in quanto il ricevente HBsAg positivo necessita di per sé, per tutta la vita, di una profilassi, al fine di prevenire la reinfezione dell’organo. I soggetti HBV-naive, ricevendo un organo HBcAb sono a più alto rischio di infezione de novo (47%), seguiti dai riceventi HBcAb+/HBsAb- (13%) e dagli HBcAb-/HBsAb+ (9%) e tali riceventi vengono pertanto trattati long-term con lamivudina o antivirali di generazioni successive; per contro i soggetti HBcAb+/HBsAb+ hanno un rischio bassissimo di nuova infezione (1.4%) ricevendo un organo HBcAb positivo (11), (Tabella 3).
In conclusione il mondo trapiantologico è in continua evoluzione e ad oggi l’indicazione a trapianto di fegato per epatopatie virali è in riduzione grazie all’impiego di antivirali che consentono di guarire, come nel caso di HCV o controllare nel tempo, come nel caso di HBV, l’infezione. L’efficacia delle attuali terapie è testimoniata dal crescente uso di organi viremici sia HBV che HCV in pazienti a loro volta viremici o naive ai virus stessi, ma le cui condizioni cliniche rendono urgente il trapianto stesso. L’alcool, la malattia dismetabolica e alcune indicazioni oncologiche di nicchia rappresentano la sfida del prossimo futuro per l’epatologo ed il chirurgo del trapianto (12).
Messaggi chiave
- Durante gli ultimi 20 anni si è assistito ad un cambiamento del panorama trapiantologico, con un progressivo declino dei pazienti che giungono al trapianto per epatopatia HCV correlata, un carico crescente di MASLD, un aumento dell’età e delle comorbidità dei candidati.
- La persistenza di una coorte di pazienti che sta invecchiando con cirrosi da infezione HDV acquisita molte decadi fa, continua ad impattare significativamente sul programma trapianto.
- L’era post-DAA ha consentito un progressivo incremento nell’uso di organi HCV viremici, indipendentemente dallo stato del ricevente, ottenendo risultati a medio e lungo termine comparabili rispetto ai riceventi di organi non viremici.
- L’alcool, la malattia dismetabolica ed alcune indicazioni oncologiche di nicchia rappresentano la sfida del prossimo futuro per l’epatologo ed il chirurgo del trapianto.
- GBD 2017 Cirrhosis Collaborators. The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol 2020;5:245–266.
- Terrault NHA, Francoz C, Berenguer M, et al. Liver transplantation 2023: status report, current and future challenges. Clin Gastroenterol Hepatol 2023;21:2150-2166.
- Goldberg D, Ditah IC, Saeian K, et al. Changes in the prevalence of hepatitis C virus infection, nonalcoholic steatohepatitis, and alcoholic liver disease among patients with cirrhosis or liver failure on the waitlist for liver transplantation. Gastroenterology 2017;152:1090-1099.
- Belli LS, Perricone G, Adam R, et al. European Liver and Intestine Transplant Association (ELITA). Impact of DAAs on liver transplantation: major effects on the evolution of indications and results. An ELITA study based on the ELTR registry. J Hepatol 2018;69:810-817.
- Manzia TM, Trapani S, Nardi A, et al. Temporal trends of waitlistings for liver transplantation in Italy: the ECALITA registry study. Dig Liver Dis 2022;54(12):1664-1671.
- Martini S, Tandoi F, Romagnoli R, Rizzetto M. Liver Transplantation in Hepatitis B/Hepatitis D (Delta) Virus Coinfected Recipients. Transplantation 106(10):1935-1939.
- Duvoux C, Belli LS, Fung J, et al. 2020 position statement and recommendations of the European Liver and Intestine Transplantation Association (ELITA): management of hepatitis B virus-related infection before and after liver transplantation. Aliment Pharmacol Ther 2021 Sep;54(5):583-605.
- Martini S, Caccamo L, Rizzetto M. Are immunoglobulins against the HBsAg still needed in liver transplantation for hepatitis D? Hepatology 2018;67(6):2475-2476.
- Saracco M, Tandoi F, Maletta F, et al. Early post-liver transplant use of direct-acting antivirals in naive and NS5A inhibitor-experienced HCV patients. J Viral Hepat 2023;30(3):201-208.
- Martini S, Salizzoni M, David E. et al. Favorable short-term outcome of hepatitis C virus-positive liver graft with bridging fibrosis: A plea for very early viral eradication. Hepatology 2017;65(6):2116-2118.
- Russo FP, Viganò M, Stock P et al. HBV-positive and HIV-positive organs in transplantation: A clinical guide for the hepatologist. J Hep 2022 77, 503-515.
- Zanetto A, Shalaby A, Gambato M, et al. New indications for liver transplantation. J Clin Med 2021;10:3867.







