A distanza di più di 40 anni dalla scoperta di HIV come agente causale dell’AIDS, e nonostante proclami, sin dagli anni ’80, riguardo al prossimo arrivo di un vaccino in grado di controllare il diffondersi del virus HIV, ancor oggi non abbiamo un vaccino disponibile, né abbiamo tracce di prossimi arrivi di candidati vaccini particolarmente promettenti con evidenze cliniche di efficacia.
Questo statement, apparentemente alquanto pessimista, in realtà si limita a definire lo stato dell’arte della ricerca sui vaccini contro l’infezione da HIV, e indica con chiarezza la complessità del lavoro da svolgere, a causa delle difficoltà generate dalle caratteristiche del virus e della patologia che esso causa.
HIV è un virus con caratteristiche uniche, a causa delle quali le procedure e gli allestimenti vaccinali utilizzati nel passato contro altri virus (vaccini a virus attenuati, uccisi, proteine ricombinanti, ecc.) hanno pochissime chance di efficacia (Tabella 1). Ciò indica la necessità di un pensare nuovo, e di utilizzare al meglio le conoscenze acquisite negli scorsi decenni riguardo sia il virus, sia le risposte immunitarie al virus, sia gli strumenti biotecnologici oggi disponibili per costruire un vaccino efficace.

HIV è un retrovirus il cui alto tasso di variabilità è legato all’elevato numero di cicli replicativi giornalieri, moltiplicato per il tasso di errore della trascrittasi inversa durante ogni ciclo replicativo, moltiplicato ancora per il numero di giorni-mesi-anni di replicazione; quest’ultimo elemento va considerato quando si paragona la variabilità di un virus che causa infezioni acute e limitate nel tempo, rispetto ad un virus, come HIV, che rimane nell’organismo in fase replicativamente attiva per tutta la vita della persona.
Per queste ragioni, HIV, come d’altra parte anche HCV, è refrattario ad essere controllato da un vaccino, non solo su milioni di persone, ma anche in un singolo individuo. Infatti vi è chiara evidenza che, nella stragrande maggioranza dei casi, il sistema immunitario reagisce all’insulto HIV producendo una risposta, sia anticorpale che cellulare, non in grado di controllare l’infezione virale. In particolare, gli anticorpi prodotti sono quasi sempre non neutralizzanti. In aggiunta, le cellule CD4 specifiche per HIV, ossia quelle in grado di combattere al meglio il virus, sono tra le prime eliminate dal virus nei primi giorni dell’infezione. Pertanto, anche supponendo una presenza monofiletica di virus (ossia con un unico ceppo virale immunologicamente costante), la risposta immunitaria è scarsamente efficiente nel controllare il virus stesso. Infine, non va dimenticato che, a causa della variabilità virale, nella stessa persona coesistono diversi ceppi, caratterizzati da significativa differenza genetica l’un l’altro, chiamati quasispecie. Il virus, posto sotto attacco dal sistema immunitario (o da un vaccino, o da un anticorpo monoclonale somministrato dall’esterno), rapidamente seleziona il ceppo/i ceppi virali che, per le loro caratteristiche, sono resistenti all’attacco immunitario, generando così il cosiddetto escape. Un altro elemento da considerare è la plasticità di HIV. Al contrario di altri virus, come morbillo e poliovirus, caratterizzati ugualmente da alta variabilità più che altro teorica, HIV ha una grande flessibilità pratica, nel senso che può accomodare nel proprio genoma variazioni delle proteine virali, senza inficiare in modo significativo la propria capacità replicativa (la variabilità di morbillo e poliovirus è limitata dal fatto che le proteine virali prodotte in caso di mutazioni sono il più delle volte non funzionali, e quindi il virus non è in grado di replicare). In tal modo abbiamo le quasispecie intra-ospite, abbiamo i sottotipi co-circolanti nel mondo (ognuno dei quali geneticamente e immunologicamente differente dagli altri), e i ricombinanti che si generano in continuazione in ogni area geografica. Tutto questo rende la ricerca di un vaccino veramente ardua.
Infine, non va dimenticata la particolare struttura della gp120, la glicoproteina di superficie che funge da legame con la cellula bersaglio. Non solo essa è altamente glicosilata (e gli zuccheri di superficie agiscono da scudo nei confronti degli anticorpi neutralizzanti, impedendo loro di raggiungere i siti vitali della proteina), ma è normalmente in una conformazione trimerica chiusa, che espone il sito di legame solamente durante un breve periodo nel corso dell’attacco alla cellula bersaglio. In queste condizioni, la neutralizzazione della gp120 è estremamente difficile, e, finora, pressoché impossibile. Abbiamo dunque perso la partita del vaccino? Sicuramente abbiamo perso tutte le battaglie finora combattute, ma abbiamo ancora numerose frecce nella nostra faretra. La più importante di esse è rappresentata dai cosiddetti Broadly-neutralizing monoclonal antibody (chiamati di solito bnAbs).
I bnAbs derivano dall’osservazione che in rari pazienti infettati da HIV, l’organismo riesce, sia pur con enorme fatica, a produrre una sotto-sottoclasse di anticorpi in grado di controllare la replicazione virale. È stato infatti notato che coloro che producono questi anticorpi bnAbs hanno normalmente una progressione della malattia estremamente lenta, in alcuni casi praticamente ferma (elite controller).
Sono oggi disponibili tecnologie, molto sofisticate, che possono permettere di isolare questi anticorpi da queste persone, e soprattutto di identificare i linfociti B che le producono. È stato anche possibile individuare antigeni in grado di stimolare questi linfociti B a produrre i bnAbs.
In sostanza, quindi, oggi abbiamo la possibilità di generare in vitro, attraverso una complessa procedura biotecnologica, bnAbs aventi la capacità teorica di controllare l’infezione e la replicazione di virus aventi caratteristiche genetiche alquanto differenti (Figura 1).
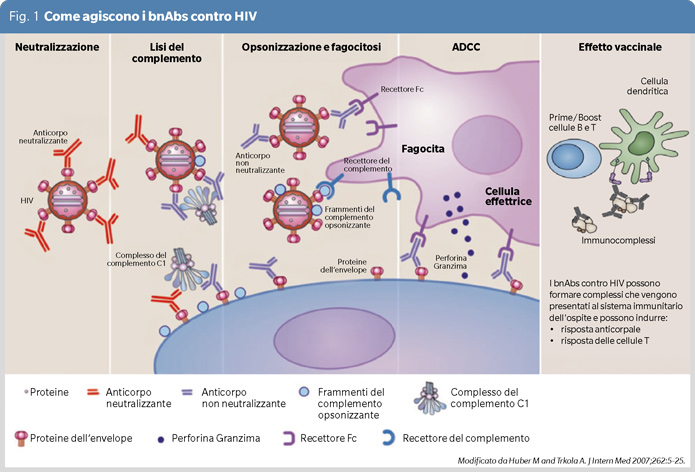
Questa tecnologia avrebbe tre possibili applicazioni. Una diretta, sotto forma di somministrazione di questi bnAbs, similmente alla somministrazione di monoclonali in tante patologie umane, al fine di controllare la replicazione virale in persone già infettate (terapia), un’altra, di impedire l’infezione in persone ad alto rischio di trasmissione (PREP – pre-exposure prophylaxis), una terza di impedire l’attecchimento di un virus già entrato nell’organismo (PEP – Post-exposure prophylaxis). Una tale tecnologia potrebbe anche essere considerata per un vaccino vero e proprio, costituito da antigeni in grado di elicitare la produzione selettiva di bnAbs.
Siamo al momento in una fase di studio; abbiamo avuto tante delusioni nel passato che lo scetticismo scientifico (che non è negativismo) è d’obbligo fino a che non avremo dati positivi in supporto alle ipotesi. Ma sicuramente qualcosa di nuovo si è mosso, e oggi le nuove tecnologie offrono spunti di speranza in un contesto, quello del vaccino contro HIV, in cui finora si sono inanellate solo sconfitte. È da considerare anche, nell’ambito delle nuove tecnologie, quella a mRNA, che ha prodotto i vaccini anti-COVID che hanno salvato la vita di milioni di persone, e che giustamente è stata riconosciuta agli scopritori con il Nobel per la Medicina. Anche questa tecnologia, che ha un potere di presentazione dell’antigene molto ma molto superiore rispetto alle tecnologie vaccinali classiche, è in avanzata fase di sperimentazione. Data la sua potenza, potrebbe superare gli ostacoli insormontabili per le tecnologie classiche e darci grandi soddisfazioni.
Aspettiamo risultati dalla clinica, e speriamo che questa volta, oltre a delusioni, si aprano prospettive concrete per una vaccinazione di massa nei confronti di questo, ancor oggi, virus letale.
- Nkolola JP, Barouch DH. Prophylactic HIV-1 vaccine trials: past, present, and future. Lancet HIV. 2024;11(2):e117-e124.
- Williams A, Menon S, Crowe M, et al. Geographic and Population Distributions of Human Immunodeficiency Virus (HIV)-1 and HIV-2 Circulating Subtypes: A Systematic Literature Review and Meta-analysis (2010-2021). J Infect Dis. 2023;228(11):1583-1591.
- Henderson R, Zhou Y, Stalls V, et al. Structural basis for breadth development in the HIV-1 V3-glycan targeting DH270 antibody clonal lineage. Nat Commun. 2023;14(1):2782.
- Huber M and Trkola A. Humoral immunity to HIV-1: neutralization and beyond. J Intern Med. 2007;262(1):5-25.
- Frattari GS, Caskey M, Søgaard OS. Broadly neutralizing antibodies for HIV treatment and cure approaches. Curr Opin HIV AIDS. 2023;18(4):157-163.
- Li S, Zhang MY, Yuan J, Zhang YX. Nano-vaccines for gene delivery against HIV-1 infection. Expert Rev Vaccines. 2023;22(1):315-326.







