L’Agenzia Europea dei Medicinali (EMA) definisce un prodotto medicinale di terapia genica una sostanza biologica che consiste in o contiene un acido nucleico ricombinante utilizzato per regolare, riparare, sostituire, aggiungere o eliminare una sequenza genetica. La terapia genica si è ampiamente sviluppata, a partire dalla seconda metà del XX secolo, grazie ai progressi compiuti nella comprensione delle basi molecolari di molte malattie umane e alla messa a punto di tecniche molecolari efficienti per il trasferimento dei geni.
Theodore Friedmann, più di quarantacinque anni fa, fu il primo ad ipotizzare l’utilizzo di queste tecnologie nella cura dei disordini monogenici ereditari (1).
Contrariamente ai trattamenti farmacologici a base proteica che richiedono infusioni ripetute, la terapia genica offre la possibilità di intervenire direttamente e tramite unica somministrazione sulle cause genetiche che determinano la malattia. I fattori che maggiormente ne determinano il successo sono: i) l’efficienza con cui il materiale genetico viene trasferito alle cellule bersaglio, poichè il numero di cellule corrette dovrà essere sufficiente per migliorare la condizione di malattia; ii) la capacità delle cellule ingegnerizzate o del sistema di trasferimento di sfuggire al riconoscimento immunologico; iii) la capacità delle cellule ingegnerizzate di sopravvivere a lungo termine o trasmettere la modifica genetica alla loro progenie.
Il target cellulare e le caratteristiche molecolari della patologia influenzano la scelta del metodo utilizzato per il trasferimento genico. I vettori virali ricombinanti - derivati da retrovirus murini, lentivirus e virus adenoassociati - sono i sistemi maggiormente utilizzati per il trasferimento degli acidi nucleici con funzione terapeutica. In questi vettori, il genoma del virus parentale è stato modificato in modo da preservare le sue capacità infettive, necessarie per trasferire con efficienza il materiale genetico, ma è stato privato di quelle replicative e patogeniche. Data la capacità di integrare il genoma virale in quello cellulare, i vettori retrovirali (VR) e lentivirali (VL) sono preferenzialmente utilizzati negli approcci di terapia genica ex vivo su cellule staminali ematopoietiche (CSE) e linfociti T. Con questi sistemi si garantisce che la modifica genetica sia permanente e venga ereditata stabilmente in tutta la progenie cellulare. Grazie all’elevato tropismo cellulare, i vettori adenovirali associati (VAA) sono ampiamente utilizzati nelle procedure di terapia genica in vivo aventi come target le cellule muscolari, neuronali, epatiche o fotorecettori della retina.
Dai primi studi a Strimvelis
I primi trial clinici per la cura di malattie genetiche rare iniziarono nei primi anni ’90, ma in molti casi i risultati ottenuti furono deludenti, a causa dell’insorgenza inaspettata di eventi avversi, quali risposte infiammatorie acute o neoplasie indotte dall’integrazione del genoma virale. Se da una parte questi eventi negativi crearono scetticismo e dubbi verso le pratiche di terapia genica, dall’altra favorirono lo sviluppo di una ricerca di base più accurata e multidisciplinare. Grazie a questa cooperazione scientifica, gli studi di fase clinica I/II effettuati negli ultimi 10 anni in più di 200 pazienti hanno mostrato chiare evidenze di efficacia e sicurezza nel trattamento di diversi disordini genetici ereditari come talassemia, emofilia, immunodeficienze congenite, leucodistrofie e distrofia retinica (Tabella 1) (2, 3).
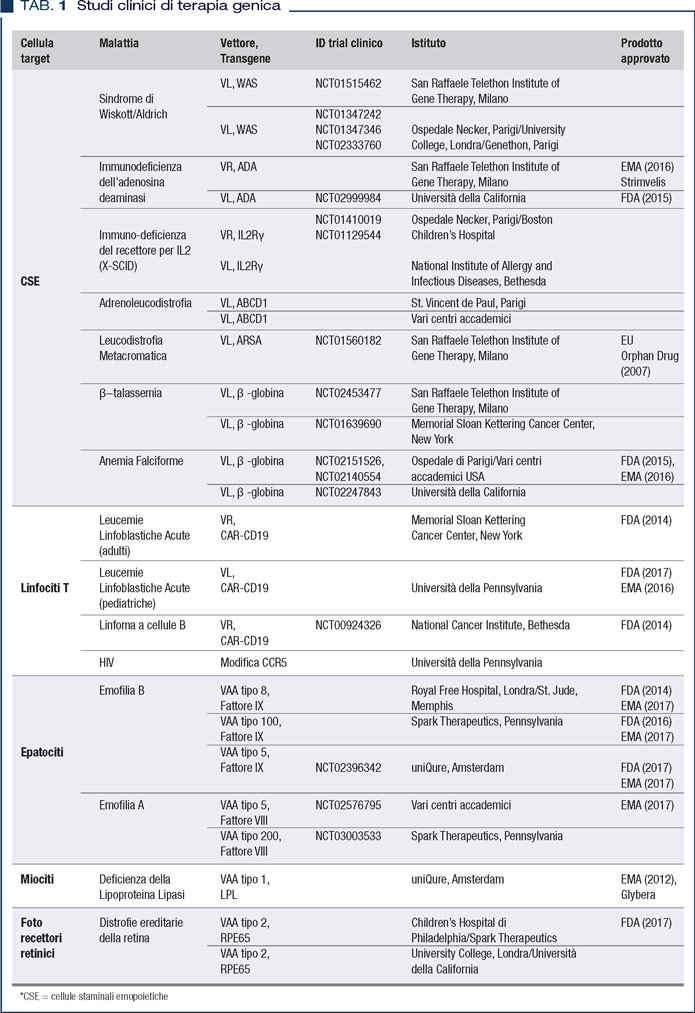
Questi risultati hanno altresì promosso l’avanzamento e l’approvazione di alcuni approcci come farmaci di elezione da parte delle autorità regolatorie europee e USA (2, 3). Un esempio tutto italiano e autorizzato alla commercializzazione da parte dell’EMA nel 2016 è rappresentato da Strimvelis, il primo medicinale di terapia genica sviluppato nei laboratori del San Raffaele Telethon Institute for Gene Therapy per la cura di pazienti affetti da un’immunodeficienza severa (4, 5).
Applicazioni/evoluzione terapeutica
Sebbene l’obiettivo più diretto e naturale per le applicazioni di terapia genica fosse la cura delle malattie monogeniche ereditarie, ben presto ci si è resi conto che lo spettro di potenzialità terapeutiche poteva essere esteso ad altre patologie ben più diffuse, quali neoplasie e malattie infettive croniche. Nella lotta contro il cancro, le strategie sviluppate sono riconducibili a due categorie: quelle che puntano direttamente alle cellule tumorali per andare a bloccare/inibire la proliferazione neoplastica, e quelle che invece mirano a potenziare la risposta immunitaria adattativa contro le cellule tumorali. Eventi di remissione tumorale completa sono stati descritti in pazienti affetti da leucemie B e trattati con cellule T ingegnerizzate per esprimere un recettore chimerico specifico che ha indotto l’attivazione di una risposta immunitaria efficace contro le cellule tumorali (6, 7).
L’ingegnerizzazione delle cellule T è stata applicata con successo anche in ambito virologico nel tentativo di contrastare l’infezione da HIV (Figura 1).
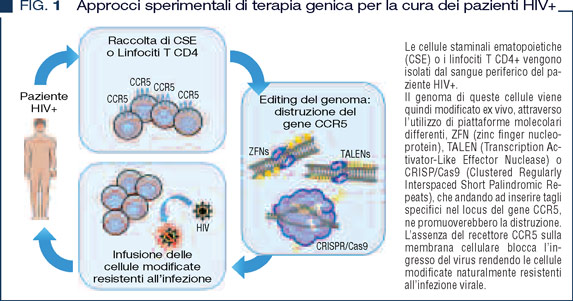
In un primo studio, linfociti T di pazienti infetti sono stati modificati geneticamente per produrre un RNA complementare al genoma virale che andasse ad interferire con il suo processo replicativo (8, 9). In uno studio successivo, applicando per la prima volta le tecniche più avanzate di terapia genica, note come targeted genome editing, si è andati ad eliminare in maniera mirata dal genoma di cellule T prelevate da pazienti sieropostivi una porzione del gene CCR5, recettore cellulare necessario per veicolare l’ingresso del virus nella cellula, e la cui assenza rende i linfociti T resistenti all’infezione virale. Sebbene entrambi gli approcci non abbiano portato all’eradicazione dell’infezione, nel sangue dei pazienti trattati si è osservata una riduzione della carica virale in assenza di terapia antiretrovirale farmacologica e selezione positiva delle cellule T modificate (8-10).
Considerando che l’eradicazione dell’infezione virale è stata osservata ad oggi solo in 2 pazienti sieropositivi sottoposti a trapianto allogenico con CSE in cui l’espressione del gene CCR5 era abrogata dalla presenza in omozigosi della mutazione naturale Δ32 (11, 12), è plausibile ipotizzare che, se le tecniche di targeted genome editing sul CCR5 avvenissero direttamente sulle CSE del paziente infetto potrebbero essere raggiunti risultati migliori e potenzialmente definitivi. Studi clinici per testare l’ipotesi sono in corso.
Aspetti etici
Infine, riguardo alle pratiche di terapia genica la comunità scientifica ha redatto un decalogo in cui ha affermato che non vi sono controindicazioni etiche o deontologiche nell’applicazione di queste procedure su cellule somatiche per scopi terapeutici, mentre è ancora prematura la loro applicazione su cellule embrionali umane (13). E’ stata infatti fortemente criticata l’attività di editing sul gene CCR5 svolta da un ricercatore cinese sulle cellule embrionali di due bambine concepite da genitori sieropositivi al fine di renderle immuni dall’infezione (14). Le conseguenze funzionali in un individuo adulto di un intervento di modifica genetica eseguito a livello embrionale non sono state ancora caratterizzate e, soprattutto in questo caso, è contestabile il fatto che nel genoma della specie umana venga introdotta una modifica ereditabile, e dalle conseguenze poco note, solo per impedire la trasmissione verticale di un’infezione virale che può facilmente essere evitata utilizzando metodi alternativi più semplici e scientificamente validati.
Bibliografia
- Friedmann T, Roblin R. Gene therapy for human genetic disease? Science 1972; 175(4025):949-55.
- Dunbar CE, et al. Gene therapy comes of age. Science 2018; 359(6372). pii:eaan4672. doi:10.1126/ science.aan4672.
- Naldini L. Gene therapy returns to centre stage. Nature 2015; 526(7573):351-60.
- Aiuti A, et al. Gene therapy for ADA-SCID, the first marketing approval of an ex vivo gene therapy in Europe: paving the road for the next generation of advanced therapy medicinal products. EMBO Molecular Medicine 2017; 9(6):737-740.
- Monaco L, Faccio L. Patient-driven search for rare disease therapies: the Fondazione Telethon success story and the strategy leading to Strimvelis. EMBO Molecular Medicine 2017; 9(3):289-292.
- Brentjens RJ, et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Science Translational Medicine 2013; 5(177):177ra38.
- Park JH, et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. The NEJM 2018; 378(5):449-459.
- Levine BL, et al. Gene transfer in humans using a conditionally replicating lentiviral vector. Proceedings of the National Academy of Sciences of the United States of America 2006; 103(46):17372-7.
- Tebas P, et al. Antiviral effects of autologous CD4 T cells genetically modified with a conditionally replicating lentiviral vector expressing long antisense to HIV. Blood; 2013. 121(9):1524-33.
- Tebas P, et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. NEJM 2014; 370(10):901-10.
- Gupta RK, et al. HIV-1 remission following CCR5 Δ32/Δ32 haematopoietic stem-cell transplantation. Nature, 2019; 568(7751):244-248.
- Hutter G, et al. Long-term control of HIV by CCR5 Δ32/Δ32 stem-cell transplantation. N Engl J Med 2009; 360(7):692-8.
- in Human Genome Editing: Science, Ethics, and Governance 2017: Washington (DC).
- Cyranoski D, Ledford H. Genome-edited baby claim provokes international outcry. Nature 2018; 563(7733):607-608.







