Fin dal 1996 la terapia triplice per l’infezione da HIV (HAART) si è fondata sulla combinazione di 2 analoghi nucleosidici/nucleotidici (NRTIs) associati ad un terzo farmaco di un’altra classe, in genere con maggiore potenza e barriera genetica più elevata.
Il progresso farmacologico ha contribuito all’evoluzione del backbone di NRTIs che, però, ha mantenuto un ruolo chiave nella costruzione dei moderni regimi terapeutici.
Lasciata l’era dei d-drugs (d4T, ddI, ddC) abbandonati in ragione della loro tossicità, il backbone di NRTI si è nel tempo ristretto a due opzioni, una includente abacavir (ABC), l’altra tenofovir disoproxil fumarato (TDF). La combinazione di ABC/3TC ha trovato un minor impiego nella pratica clinica, sia per il rischio di reazione di ipersensibilità che per il rischio cardiovascolare riportato in alcuni studi osservazionali, nonostante sia il backbone della single-tablet regimen (STR), includente dolutegravir, che ha confermato la propria alta efficacia virologica, anche in confronto ai regimi più moderni (1).
Per contro, TDF, utilizzato ad oggi in Italia in decine di migliaia di pazienti, ha consentito ai clinici di maturare una lunga esperienza con i regimi contenenti questo analogo nucleotidico, confermandone sia l’efficacia virologica che la tossicità renale ed ossea, specie quando associato ai PI con booster di ritonavir. La sua evoluzione farmacologica (2), ovvero il profarmaco tenofovir alafenamide (TAF), con concentrazioni plasmatiche di tenofovir di gran lunga inferiori (-90%) ed un elevato accumulo intracellulare, presenta minore tossicità, a fronte di una simile efficacia antivirale. Oggi TAF, in associazione a FTC, è incluso in ben 4 STR, coformulate rispettivamente con rilpivirina, elvitegravir/cobicistat, darunavir/cobicistat e bictegravir, rappresentando una opzione di prima scelta anche nei pazienti coinfetti con HBV.
Sotto il profilo delle resistenze, l’alta barriera genetica di alcuni regimi a tre farmaci (con inibitore delle proteasi, dolutegravir o bictegravir) ha protetto molto efficacemente il backbone nucleosidico/nucleotidico, azzerando il tasso di resistenza genotipica nei fallimenti virologici dei pazienti naive.
Tutte queste opzioni hanno risposto alle esigenze di massima semplificazione dei regimi terapeutici, integrando gli antivirali in una singola pillola, ma lasciando inalterato il paradigma della triplice combinazione. Infatti, per oltre due decadi, la HAART si è identificata nel regime triplice, seppur diversi siano stati i tentativi di strategie alternative NRTI-sparing finalizzati a evitarne la tossicità che offrissero la stessa efficacia virologica anche nei setting più complessi.
Tuttavia gli studi NEAT (con darunavir/r + RAL) (3), MODERN (con darunavir/r + maraviroc) (4) o le strategie di monoterapia con inibitori delle proteasi (studi MONET e MONOI) (5-6) hanno dimostrato come tali alternative non fossero ugualmente efficaci rispetto ai regimi includenti 2 NRTI, suggerendo che l’inibizione della transcrittasi inversa sia necessaria per una ottimale inibizione della replicazione di HIV.
Per tale motivo, altre opzioni terapeutiche hanno esplorato l’ipotesi di mantenere l’inibizione della trascrittasi inversa con regimi duplici includenti un solo NRTI (Tabella 1).
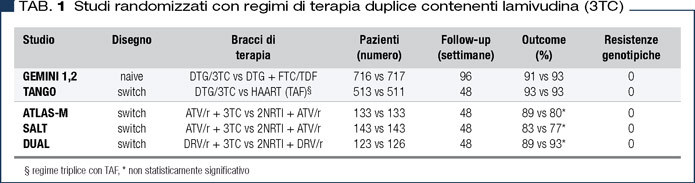
In particolare, le associazioni di inibitori delle proteasi boosterati con 3TC (negli studi SALT, ATLAS-M e DUAL), anche se limitatamente alle strategie di switch, hanno dimostrato di poter garantire il controllo viroimmunologico a 48 settimane (7).
Successivamente, la combinazione di dolutegravir e 3TC ha dimostrato, sia nella popolazione naive (studi GEMINI) (8) che nelle strategie di switch (studio TANGO) (9), di ottenere un controllo virologico e di garantire una alta barriera genetica simile al regime a 3 farmaci, includente 2NRTI.
Il successo dei regimi a due farmaci ha riproposto 3TC come protagonista di regimi semplificati ed efficaci, in ragione della alta tollerabilità, della scarsa tossicità, dell’assenza di interazione tra farmaci, dell’efficacia su HBV e, infine, del suo basso costo.
Infine, molti dati emergenti suggeriscono il ruolo di 3TC anche in pazienti con un virus che ha documentato una pregressa mutazione M184V (10), a patto che il farmaco sia inserito in un regime ad alta barriera genetica e che il paziente abbia una lunga storia di soppressione virologica (in genere della durata di anni) dopo l’emergenza della resistenza. Questo a conferma della sua possibile scomparsa nel tempo, dato inatteso e non coerente con l’assunto generale che una mutazione genotipica, una volta verificatasi, sia sempre pronta a riemergere.
Opzioni future
L’orizzonte degli NRTI/NtRTI è ancora promettente, in particolare con un nuovo farmaco nucleosidico in fase avanzata di sviluppo. Questo farmaco (islatravir), che è un inibitore della traslocazione (NRTTI), presenta un doppio meccanismo di azione che consente un blocco più efficiente della transcrittasi inversa, con maggiore potenza antivirale e minor rischio di resistenze.
Sono stati presentati i risultati dello studio randomizzato e controllato di fase 2, sulla combinazione di islatravir (a dosaggi di 0.5, 0.75 e 2.25 mg) con doravirina e 3TC, in 121 pazienti naive alla terapia e con CD4 > 200 cellule/mmc (11). Il braccio di controllo era la singola compressa di doravirina/3TC/TDF.
Alla settimana 24, coloro che avevano < 50 copie/ml toglievano 3TC, rimanendo con islatravir + doravirina. I risultati alla settimana 48 indicano una soppressione virologica rispettivamente pari a 89.7%, 90.0% e 77.4% nei pazienti con i tre dosaggi di islatravir, rispettivamente, e comunque simile al braccio di controllo (83.9%).
Un altro NRTI (GS-9131) è in fase preliminare di sviluppo ed ha la caratteristica di mantenere in vitro una attività antivirale anche nei confronti di virus resistenti agli NRTI di precedente generazione, compresa la presenza della mutazione K65R (12). Come sopra dimostrato, a distanza di oltre venti anni dalla introduzione della HAART, gli NRTI continuano a giocare un ruolo chiave nei regimi moderni e nelle future strategie terapeutiche.
Bibliografia
- Gallant J, Lazzarin A, Mills A, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet. 2017; 390(10107):2063-2072.
- Ray AS, Fordyce MW, Hitchcock M. Tenofovir alafenamide: A novel prodrug of tenofovir for the treatment of Human Immunodeficiency Virus. Antiviral Res. 2016; 125:63-70.
- Raffi F, Babiker AG, Richert L, et al. Ritonavir-boosted darunavir combined with raltegravir or tenofovir-emtricitabine in antiretroviral-naive adults infected with HIV-1: 96 week results from the NEAT001/ANRS143 randomised non-inferiority trial. Lancet. 2014; 384(9958):1942-51.
- Stellbrink HJ, Le Fevre E, Carr A, et al. Once-daily maraviroc versus tenofovir/emtricitabine each combined with darunavir/ritonavir for initial HIV-1 treatment. AIDS. 2016; 30:1229-38.
- Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. https://aidsinfo.nih.gov/guidelines/html/1/adult-and-adolescent-arv/05-6.
- European AIDS Clinical Society. Treatment guidelines. Version 9.0. 2019. https://www.eacsociety.org/guidelines/eacs-guidelines/eacs-guidelines.html.
- Perez-Molina JA, Pulido F, Di Giambenedetto S, et al. Individual patient data meta-analysis of randomized controlled trials of dual therapy with a boosted PI plus lamivudine for maintenance of virological suppression: GeSIDA study 9717. J Antimicrob Chemother. 2018; 73:2927-2935.
- Cahn P, Sierra Madero J, Arribas J, et al. Durable efficacy of dolutegravir (DTG) plus lamivudine (3TC) in antiretroviral treatment-naïve adults with HIV-1 infection - 96-week results from the GEMINI studies. 10th IAS Conference on HIV Science (IAS 2019), 21-24 July 2019, Mexico City. Late-breaker oral Abstract WEAB0404LB.
- Van Wyk, Ajana JF, Bisshop F, De Wit S, et al. Switching to DTG + 3TC fixed dose combination (FDC) is non-inferior to continuing a TAF-based regimen (TBR) in maintaining virologic suppression through 24 weeks (TANGO study). Presented at the 10th International AIDS Conference for HIV Science (IAS 2019), 21-24 July 2019, Mexico City, Mexico. Slides WEAB0403LB.
- Ripamonti D, Zazzi M. Rethinking recycling nucleoside reverse transcriptase inhibitors in HIV treatment: learning from dual therapy studies. AIDS 2018; 32:835-840.
- Molina J-M, Yazdanpanah Y, Afani Saud A, et al. MK-8591, at doses of 0.25 to 2.25 mg QD, in combination with doravirine establishes and maintains viral suppression through 48 weeks in treatment-naive adults with HIV-1 infection. Late-breaking Oral Presentation. Wednesday, July 24. Abstract WEAB0402LB.
- Ibanescu R-I, Oliveira M, Spira B, et al. Favourable outcome on in vitro selections with novel prodrug GS-9131. CROI 2019, Seattle. Abstract Number: 482.







