Le attuali terapie biologiche, che impiegano anticorpi monoclonali, agenti anti-recettori e inibitori delle vie di trasduzione del segnale, svolgono un ruolo imprescindibile nel trattamento di numerose malattie infiammatorie e autoimmuni (in particolare, malattie reumatiche, dermatologiche, gastrointestinali e neurologiche), così come nell'immunomodulazione terapeutica delle malattie ematologiche maligne. Tuttavia, molti di questi immunomodulanti interferiscono anche con meccanismi cruciali per la protezione dell’ospite contro diversi agenti patogeni ed il loro uso può essere associato ad aumentato rischio di infezioni gravi, molte delle quali di natura opportunistica, incluse infezioni fungine invasive (IFI) (1-2).
I funghi non sono emersi come importanti patogeni umani fino alla fine del XX secolo, quando l'epidemia di HIV/AIDS e i grandi progressi nella medicina moderna hanno portato ad un significativo incremento dei pazienti con immunodeficienza iatrogena, che si prevede continuerà ad incrementare, in virtù dello sviluppo senza precedenti dei recenti farmaci immunomodulanti. I funghi appartenenti a cinque generi (Candida, Aspergillus, Cryptococcus, Pneumocystis, Mucorales) sono responsabili di più del 90% delle IFI nell'uomo. I fattori di rischio dell'ospite per queste infezioni variano notevolmente a seconda della specie fungina. I dispositivi medici impiantati, l'uso di cateteri venosi centrali, la neutropenia, l'uso di antibiotici ad ampio spettro e gli interventi di chirurgia intra-addominale sono noti fattori predisponenti per la candidosi invasiva, sottolineando l'importanza del sistema reticolo-endoteliale e della barriera mucosale nella prevenzione di questo tipo di infezioni. Inoltre, i pazienti con neutropenia e/o esposti a terapie corticosteroidee, nell'ambito di neoplasie ematologiche o trapianto, e i pazienti con immunodeficienze primarie associate a disfunzione dei neutrofili, come la malattia granulomatosa cronica, sono ad incrementato rischio di aspergillosi e mucormicosi. Sebbene i neutrofili giochino un ruolo chiave nel controllo di queste infezioni, nondimeno un difetto quantitativo e/o qualitativo delle cellule T CD4+, come avviene nel caso dell'infezione da HIV, aumenterebbe significativamente il rischio di infezioni da Cryptococcus e Pneumocystis jirovecii. La conoscenza degli specifici fattori di suscettibilità immunitaria per gli specifici funghi è fondamentale per comprendere la patogenesi e le manifestazioni cliniche delle IFI associate agli immunomodulanti nei pazienti a rischio.
Rischio e incidenza di infezioni fungine
Analizzare i dati disponibili attualmente sul rischio e l’incidenza di infezioni fungine tra i pazienti che assumono farmaci biologici è ardua impresa. In primo luogo, molti pazienti che assumono biologici hanno una sottostante disregolazione immunitaria, che di per sé li predispone ad infezioni fungine; inoltre, tali farmaci sono spesso usati in combinazione con altri agenti immunosoppressivi che concorrono ad aumentare ulteriormente il rischio di infezioni opportunistiche. In secondo luogo, molti studi circa il profilo di sicurezza dei biologici riportano solo il rischio di infezioni gravi. Tale dato è estremamente grossolano, perché include infezioni virali, batteriche, micobatteriche, fungine e parassitarie. Le infezioni fungine, specialmente le IFI, sono relativamente rare e rappresentano solo una piccola percentuale di infezioni gravi, il che rende difficile correlare univocamente i risultati e tali complicanze. In terzo luogo, alcune malattie fungine, come l’istoplasmosi, la coccidioidomicosi e la blastomicosi, sono generalmente confinate a specifiche aree del mondo, quindi gli studi in cui la maggioranza dei partecipanti sono reclutati da regioni non endemiche, non possono valutare il rischio globale di infezione da questi patogeni. Infine, molti degli agenti immunomodulanti di più recente immissione in commercio sono in uso da pochi anni e non sono al momento disponibili dati di sorveglianza post-marketing sulla comparsa di complicanze infettive micotiche.
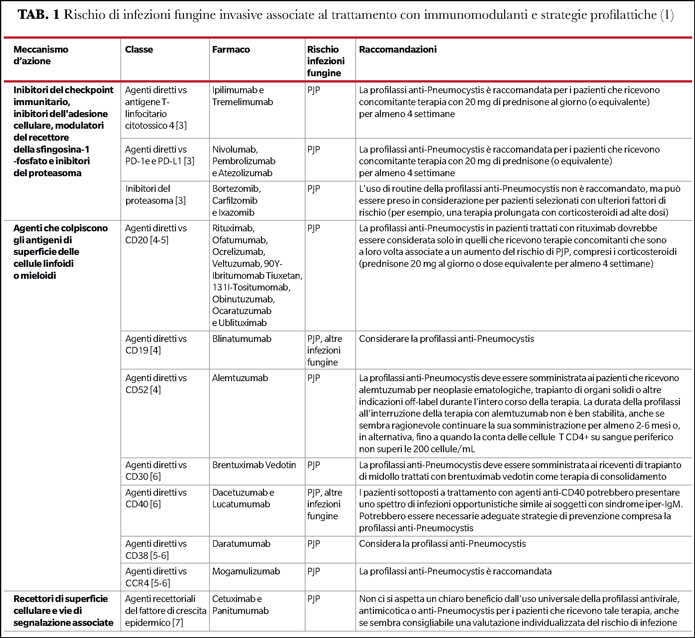
In Tabella 1 sono riportate le principali IFI associate alla somministrazione delle differenti classi di immunomodulanti e le strategie profilattiche atte a minimizzare il rischio di sviluppo di complicanza infettiva conclamata.
La corretta gestione dei pazienti
Uno dei passaggi fondamentali ai fini della corretta gestione dei pazienti trattati con questi farmaci innovativi è effettuare un'accurata anamnesi, analizzando l’eventualità di una precedente esposizione a miceti e i possibili determinanti patogeni dell'insorgenza dell'infezione. È importante sottolineare che il rischio di IFI non dipende esclusivamente dall'esposizione ai funghi o dal trattamento biologico, ma anche dal possibile effetto congiunto con altri immunomodulatori e agenti chemioterapici somministrati contemporaneamente. Bisognerebbe peraltro ispezionare la comparsa di micosi invasive, tenendo conto che gli agenti biologici possono alterare la presentazione tipica delle infezioni fungine e mettere in atto tempestive misure diagnostico-terapeutiche per ridurre la morbilità e la mortalità che ne possono derivare.
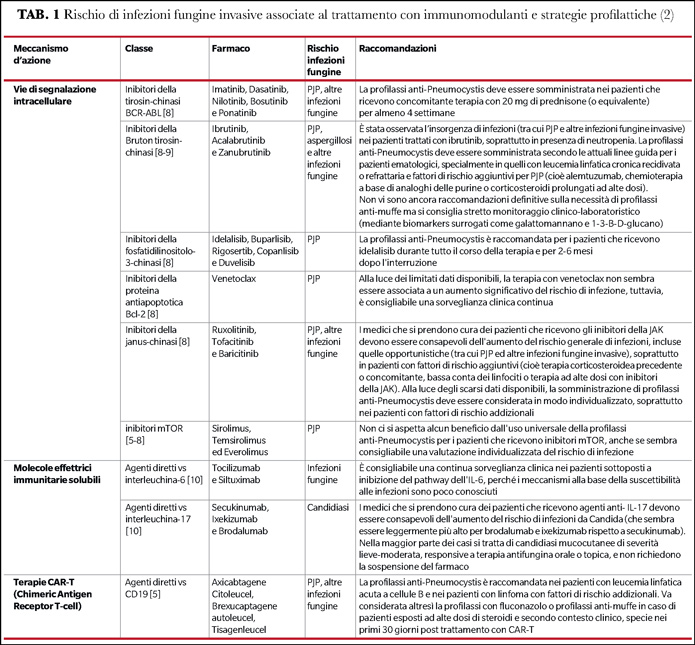
È anche importante indagare l’area geografica di provenienza e, secondo l’epidemiologia locale, eseguire una ricerca mirata dei patogeni, attraverso ad esempio la rilevazione di antigeni di Histoplasma e Coccidioides nelle urine e/o nel sangue. Durante il trattamento, è essenziale monitorare i livelli leucocitari e iniziare le profilassi del caso (Tabella 1). Inoltre, bisogna tener presente che, a differenza della tubercolosi e della leishmaniosi, che sono caratterizzate prevalentemente da riattivazioni di infezioni latenti, molte malattie fungine in questa particolare popolazione di pazienti potrebbero essere considerate infezioni de novo, anche se a questo proposito persistono dubbi su pneumocistosi e criptococcosi.
Lo screening per IFI prima di iniziare le terapie biologiche non ha dimostrato una valida efficacia. La scelta delle profilassi deve basarsi piuttosto sulla storia medica del paziente: se ha già contratto qualche IFI e se mostra fattori di rischio specifici per alcune IFI in particolare (Tabella 1).
Le misure di informazione destinate a questi pazienti potrebbero essere altrettanto importanti per evitare situazioni e attività ad alto rischio di esposizione a burden micotico, specialmente in ambienti con un'alta densità di spore o conidi. Pertanto, anche gli ambienti in cui il paziente vive o lavora, inclusi eventuali viaggi in aree endemiche per alcune micosi, andrebbero attentamente considerati. Infine, dovremmo istruire i pazienti, i parenti e il personale medico sui principali sintomi e segni di IFI e sulla maggiore suscettibilità a tali complicanze in questo setting.
Conclusioni
Le infezioni fungine invasive costituiscono tuttora condizioni cliniche associate ad elevata morbilità e mortalità, la cui incidenza aumenta proporzionalmente con l’assunzione di trattamenti immunomodulanti. Il continuo incremento delle indicazioni autorizzate e l’implementato sviluppo di questi farmaci delineano nuove categorie di pazienti con immunosoppressione iatrogena prevista o imprevista, richiedendo una maggiore sorveglianza clinica e una segnalazione tempestiva delle infezioni opportunistiche fungine. Sono necessari dati epidemiologici post-marketing e studi caso-controllo per identificare il rischio effettivo dei singoli immunomodulanti per le IFI, anche oltre il contesto di pazienti selezionati per i trial clinici. Ulteriori ricerche sui meccanismi d’azione degli antimicotici e sugli effetti dannosi che gli immunomodulanti hanno sul sistema immunitario innato e adattativo dovrebbero consentire una migliore stratificazione del rischio e di mettere in atto strategie profilattiche personalizzate. Di fronte ad un fermentante armamentario di nuovi farmaci biologici, è perentorio per i medici non perdere di vista i rischi che queste terapie comportano per lo sviluppo di infezioni fungine. Man mano che l'impiego degli immunomodulanti prende piede, uno screening attento dei fattori di rischio prima dell'inizio del trattamento, misure profilattiche mirate e un attento monitoraggio in corso di terapia possono aiutare a contenere il rischio di complicanze infettive micotiche.
Bibliografia
- Fernández-Ruiz M, Meije Y, Manuel O, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Introduction). Clin Microbiol Infect. 2018; 24 Suppl 2:S2-S9.
- Davis MR, Thompson GR 3rd, Patterson TF. Fungal infections potentiated by biologics. Infect Dis Clin North Am. 2020; 34:389-411.
- Redelman-Sidi G, Michielin O, Cervera C, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Immune checkpoint inhibitors, cell adhesion inhibitors, sphingosine-1-phosphate receptor modulators and proteasome inhibitors). Clin Microbiol Infect. 2018 J; 24 Suppl 2:S95-S107.
- Mikulska M, Lanini S, Gudiol C, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Agents targeting lymphoid cells surface antigens [I]: CD19, CD20 and CD52). Clin Microbiol Infect. 2018; 24 Suppl 2:S71-S82.
- National Comprehensive Cancer Network Guidelines. Prevention and treatment of cancer-related nfections. Version 1.2021. https://www.nccn.org/login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/infections.pdf; ultimo accesso 24/10/2021.
- Drgona L, Gudiol C, Lanini S, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Agents targeting lymphoid or myeloid cells surface antigens [II]: CD22, CD30, CD33, CD38, CD40, SLAMF-7 and CCR4). Clin Microbiol Infect. 2018; 24 Suppl 2:S83-S94.
- Aguilar-Company J, Fernández-Ruiz M, García-Campelo R, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Cell surface receptors and associated signaling pathways). Clin Microbiol Infect. 2018; 24 Suppl 2:S41-S52.
- Reinwald M, Silva JT, Mueller NJ, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Intracellular signaling pathways: tyrosine kinase and mTOR inhibitors). Clin Microbiol Infect. 2018; 24 Suppl 2:S53-S70.
- Holowka T, Cheung H, Malinis M, et al. Incidence and associated risk factors for invasive fungal infections and other serious infections in patients on ibrutinib. J Infect Chemother. 2021: 27:1700-1705.
- Winthrop KL, Mariette X, Silva JT, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [II]: agents targeting interleukins, immunoglobulins and complement factors). Clin Microbiol Infect. 2018; 24 Suppl 2:S21-S40.







