L’accesso alla terapia antiretrovirale nei paesi in via di sviluppo (low income countries, LMIC) ha permesso di migliorare enormemente la gestione dell’infezione da HIV-1 abbassando notevolmente i tassi di mortalità per AIDS e la trasmissione materno fetale dell’infezione (1-3). I regimi antiretrovirali basati sugli inibitori non-nucleosidici della trascrittasi inversa (NNRTI), seppur abbiano innegabilmente salvato milioni di vite, hanno contribuito allo sviluppo di elevati livelli di resistenza a causa della loro bassa barriera genetica (2-3). Tale fenomeno è diventato molto importante, soprattutto nell’Africa subsahariana, compromettendo l’efficacia delle terapie disponibili. L’introduzione degli inibitori dell’integrasi (INI) e soprattutto di dolutegravir (DTG), inibitore di seconda generazione ad alta barriera genetica, ha dato un’ulteriore opportunità di trattamento nei LMIC.
L’Organizzazione Mondiale della Sanità (OMS) ha ritenuto infatti fondamentale l’utilizzo di DTG per migliorare i tassi di soppressione virale globale, ed ha previsto la transizione programmatica a questo farmaco per tutti coloro fossero trattati con regimi basati su NNRTI, sia di prima, seconda o successive linee a causa di fallimenti virologici (2-3). Considerando l’estensivo utilizzo di questo farmaco in un contesto sanitario in cui il monitoraggio della carica virale e della resistenza è spesso carente, lo scopo di questo articolo è di esplorare l’attuale prevalenza della resistenza emersa a questo farmaco e valutare le conseguenze di questo fenomeno in futuro.
Prevalenza della resistenza emergente a dolutegravir nei LMIC
I regimi antiretrovirali contenenti DTG hanno dimostrato un eccellente efficacia, contribuendo a migliorare il controllo della diffusione dell’infezione da HIV. Una recente meta-analisi da studi effettuati in Africa subsahariana ha stimato che l’88.51% [73.83-97.80] di individui che hanno ricevuto regimi contenenti DTG abbia raggiunto una viremia <50 copie/ml dopo 2-24 mesi di trattamento e tale proporzione sale al 90-95% considerando il raggiungimento di viremia <1000 copie/mL (1), soglia a oggi considerata dall’OMS obiettivo della terapia antiretrovirale nei LMIC. A livello globale negli studi clinici su popolazioni naïve al trattamento antiretrovirale, il fallimento ai trattamenti di prima linea contenenti DTG, oltre a essere molto raro, è stato raramente accompagnato dall’emergenza di mutazioni di resistenza (<0.1%) (2-3). Tuttavia i tassi di emergenza di resistenza sono risultati più alti (>3-4%), ad esempio nei regimi di seconda linea contenenti DTG, dove si osserva un rischio più elevato di sviluppare resistenza nei bambini e nei contesti in cui la scelta della terapia antiretrovirale non era genotipo-guidata (2).
Diversi studi multicentrici hanno descritto la transizione dai vecchi regimi ART alla formulazione in singola compressa contenente DTG/lamivudina/tenofovir disoproxil fumarato (TLD) o a terapie combinate con DTG + 2 inibitori nucleosidici della trascrittasi inversa (NRTI) nei LMIC.
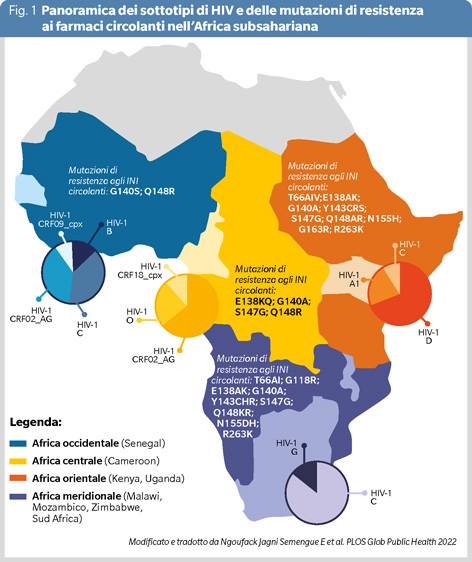 L’Africa è sicuramente il continente in cui questa transizione è stata particolarmente rilevante e, considerando la scarsa disponibilità di strumenti di monitoraggio, quali la carica virale e la genotipizzazione del virus, seppur ancora in maniera lenta, la resistenza sta iniziando a emergere anche per farmaci ad alta barriera come DTG. Nella figura 1 è rappresentata una mappa del continente con le mutazioni agli INI attualmente circolanti.
L’Africa è sicuramente il continente in cui questa transizione è stata particolarmente rilevante e, considerando la scarsa disponibilità di strumenti di monitoraggio, quali la carica virale e la genotipizzazione del virus, seppur ancora in maniera lenta, la resistenza sta iniziando a emergere anche per farmaci ad alta barriera come DTG. Nella figura 1 è rappresentata una mappa del continente con le mutazioni agli INI attualmente circolanti.
Nella tabella 1 sono riportati i dati di prevalenza di resistenza nel LMIC in alcuni lavori osservazionali pubblicati negli ultimi 2 anni. La stima dei tassi di resistenza di questi studi è sicuramente sottovalutata dal fatto che caratteristiche comuni di questi lavori erano la generale mancanza di dati pregressi sulla storia di resistenza degli individui, carenti informazioni sulla carica virale al momento del cambio a DTG e genotipizzazioni spesso effettuati dopo prolungati fallimenti in terapia.
In particolare, in uno studio effettuato in Tanzania sono stati valutati i casi di fallimento virologico (viremia>1000 copie/mL) a TLD in 92 bambini e 45 adulti (4); la prevalenza di resistenza è risultata elevata per gli NRTI (62.8%) e gli NNRTI (44.5%) mentre la resistenza agli INI si attestava attorno al 9% con l’emergenza di molte mutazioni in grado di diminuire la suscettibilità a DTG (Q148K, E138K, G118R, G140A, T66A, R263K, T97A, Q95Q/K). Tra tutti gli individui con resistenza agli INI, sono state rilevate anche mutazioni conferenti resistenza agli NNRTI e NRTI, inclusi lamivudina (3TC) e tenofovir (TDF). Tuttavia, non essendo disponibile uno storico di resistenza non è stato possibile valutare se le mutazioni conferenti resistenza agli NRTI fossero emerse sotto il trattamento con DTG.
Nel 2018, il Malawi ha effettuato la transizione a TLD per 750.000 persone con pregressa esperienza di trattamento in assenza di test della carica virale. Uno studio osservazionale prospettico, a un anno da questa transizione, ha riportato che 37/1792 (2%) individui risultavano in fallimento virologico. Due individui, entrambi viremici e resistenti a 3TC e TDF al basale, hanno manifestato resistenza a DTG (R263K e G118R) al sesto mese di trattamento. Pertanto l’incidenza di resistenza all’INI risultava del 4.7% (2/37) tra gli individui con resistenza a 3TC e TDF, evidenziando un potenziale aumentato rischio di emergenza di resistenza in coloro che ricevevano solo un agente completamente attivo (DTG) (5).
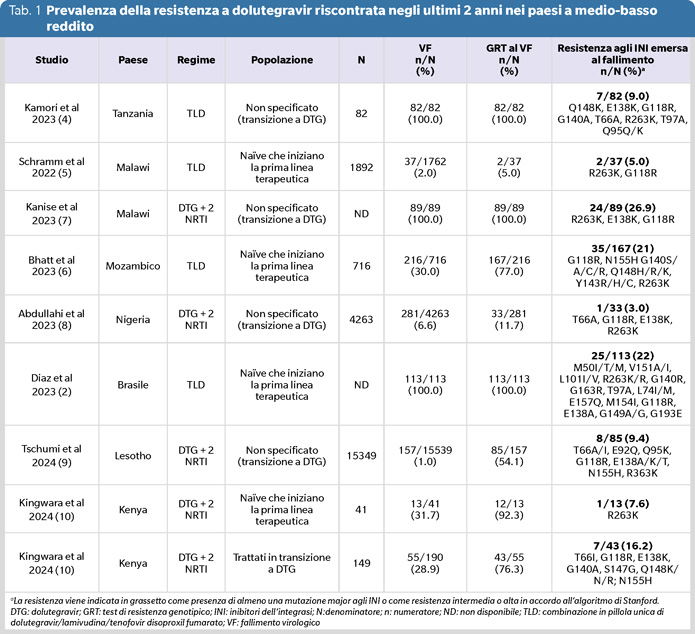
Due studi recenti illustrano la situazione attuale in Mozambico (6-7). Il primo studio è stato effettuato su 716 persone in transizione a TLD tra agosto 2021 e febbraio 2022 e ha identificato 216 individui in fallimento virologico (6). Sono stati osservati livelli intermedi o alti di resistenza a DTG in 35/167 (21.0%) individui, specialmente in coloro che avevano iniziato il trattamento con DTG con viremia rilevabile (19.4%) o in assenza di misurazione della carica virale (40.5%) (6). Il secondo studio, ha invece rilevato la presenza di resistenza a DTG in 24/89 (26.9%) individui al fallimento (7).
Riguardo la Nigeria, altro paese con un’alta incidenza di infezione da HIV, uno studio monocentrico condotto nel 2021 ha mostrato che tra 4263 individui che ricevevano DTG da almeno 6 mesi, 281 (6.6%) risultavano in fallimento virologico. Di questo gruppo, il test di resistenza è stato effettuato in soli 33 individui trattati con TLD, di cui uno con infezione verticale che aveva multiple mutazioni di resistenza agli INI rilevabili (8). Altri due recenti studi effettuati in Lesotho e Kenya mostrano un’emergenza di resistenza >7% in diverse popolazioni in transizione a trattamenti con DTG (9-10).
Un altro dato importante riguarda la resistenza a livello pediatrico. Uno studio sudafricano ha evidenziato una considerevole resistenza tra i bambini sotto i 3 anni e identificato uno dei primi casi di resistenza a DTG nei bambini. Su 135 bambini testati, la resistenza agli NNRTI si attestava al 55% mentre quella per gli NNRTI al 10%. In un bambino infettato durante l’allattamento è stata evidenziata la presenza delle mutazioni di resistenza a DTG E138K e G118R (11).
Oltre che in Africa subsahariana, il tasso di resistenza emergente dopo fallimento alla prima linea contenente DTG risulta più alto anche in Brasile. In questo paese, un recente studio ha riportato che tra 113 individui al fallimento della terapia TLD di prima linea, 4 (3.5%) presentavano la mutazione R263K specifica per DTG di cui 2 insieme a mutazioni associate agli NRTI (K70E e M184V) (2).
Fattori di rischio associati allo sviluppo di resistenza a DTG
I risultati di prevalenza di resistenza osservati suggeriscono che nell’attuale pratica clinica di routine, la resistenza emergente a DTG viene gradualmente rilevata in diversi scenari di individui in fallimento virologico, soprattutto quando:
- la transizione a DTG deriva da un regime di prima linea basato su NNRTI senza considerare la carica virale e la potenziale presenza di mutazioni chiave come la K65R e M184V
- dopo un cambio di trattamento in caso di individui multiresistenti
- dopo trattamento concomitante con DTG e farmaci antitubercolari.
La crescente comparsa di resistenza ai DTG sottolinea la necessità di un uso cauto e attento di questo farmaco molto potente (12). Fortunatamente la gran parte degli studi e un recente studio globale dimostrano che tra le persone con viremia rilevabile sotto DTG, la resistenza risulta rara (13).
Gli autori però rilevano che la presenza di resistenza agli NRTI aumenta sostanzialmente il rischio di resistenza a DTG (13). Tale fenomeno è preoccupante, considerando che in contesti con risorse limitate, il monitoraggio della resistenza prima dell’inizio della terapia con DTG è scarso.
Conclusioni
Nonostante la disponibilità globale di un farmaco estremamente potente, ad alta barriera genetica e ben tollerato come DTG, le azioni necessarie a sostenere a lungo termine il successo della ART sono ancora tante. Il graduale aumento della resistenza agli INI nei LMIC è un problema reale che deve essere gestito in maniera urgente affinché possa essere preservata l’attività di DTG.
Implementare test per il monitoraggio della viremia e della resistenza a basso costo, rafforzare il counseling per aumentare l’aderenza alla terapia, monitorare prontamente i fallimenti virologici (sia in termini di carica virale >50-400 copie/mL che di genotipizzazione) ed evitare di mantenere una prolungata replicazione virale sotto pressione di DTG sono azioni fondamentali che devono essere urgentemente implementate.
Tali azioni andrebbero messe in atto di pari passo a un intervento umanitario e sociologico per sradicare lo stigma dell’infezione da HIV e consolidare la percezione del rischio di infezione tra gli individui più fragili. Solo in questo modo si potrà ottimizzare la diagnosi e la gestione di questa infezione ancora terribile, e conseguentemente controllarne la sua diffusione.
- Ngoufack Jagni Semengue E, Santoro MM, Ndze VN, et al. HIV-1 integrase resistance associated mutations and the use of dolutegravir in Sub-Saharan Africa: A systematic review and meta-analysis. PLOS Glob Public Health. 2022;2(10):e0000826.
- Henegar C, Letang E, Wang R, et al. Comprehensive Literature Review of Treatment-Emergent Integrase Resistance with Dolutegravir-Based Regimens in Real-World Settings. Viruses. 2023;15(12):2426.
- Chu C, Tao K, Kouamou V, et al. Prevalence of Emergent Dolutegravir Resistance Mutations in People Living with HIV: A Rapid Scoping Review. Viruses. 202416(3):399.
- Kamori D, Barabona G, Rugemalila J, et al. Emerging integrase strand transfer inhibitor drug resistance mutations among children and adults on ART in Tanzania: Findings from a national representative HIV drug resistance survey. J. Antimicrob. Chemother. 2023:78:779-787.
- Schramm B, Temfack E, Descamps D, et al. Viral suppression and HIV-1 drug resistance 1 year after pragmatic transitioning to dolutegravir first-line therapy in Malawi: a prospective cohort study. Lancet HIV. 2022;9(8):e544-e553.
- Bhatt N, Ismail N, Magule C, et al. HIV drug resistance profile in clients experiencing treatment failure after the transition to a dolutegravir-based, first-line antiretroviral treatment regimen in Mozambique. In Proceedings of the 12th IAS Conference on HIV Science, Brisbane, Australia, 23–26 July 2023. Poster LBEPB16.
- Kanise H, van Oosterhout JJ, Bisani P, et al. Virological Findings and Treatment Outcomes of Cases That Developed Dolutegravir Resistance in Malawi’s National HIV Treatment Program. Viruses. 2023;16(1):29.
- Abdullahi A, Kida IM, Maina UA, et al. Limited emergence of resistance to integrase strand transfer inhibitors (INSTIs) in ART-experienced participants failing dolutegravir-based antiretroviral therapy: a cross-sectional analysis of a Northeast Nigerian cohort. J Antimicrob Chemother. 2023;78(8):2000-2007.
- Tschumi N, Lukau B, Tlali K, et al. Emergence of acquired dolutegravir resistance in treatment-experienced people with HIV in Lesotho. Clin Infect Dis. 2024 Apr 3:ciae185.
- Kingwara L, Morangi V, Madada R et al. Dolutegravir (DTG) resistance among ART-experienced viremic patients in Kenya receiving DTG-based ART. CROI 2024 Poster 677. https://www.croiconference.org/wp-content/uploads/sites/2/posters/2024/677.pdf
- Anderson K, van Zyl G, Hsiao NY, et al. HIV Drug Resistance in Newly Diagnosed Young Children in the Western Cape, South Africa. Pediatr Infect Dis J. 2024;43(10):970-976.
- Fokam J, Inzaule S, Colizzi V, et al. HIV drug resistance to integrase inhibitors in low- and middle-income countries. Nat Med. 2024;30(3):618-619.
- Loosli T, Hossmann S, Ingle SM, et al. HIV-1 drug resistance in people on dolutegravir-based antiretroviral therapy: A collaborative cohort analysis. Lancet HIV. 2023;20: e733-e741.







