L’utilizzo degli inibitori della proteasi (PI) ha radicalmente aumentato l'aspettativa di vita delle persone con infezione da HIV (People Living with HIV, PLWH), benché inizialmente gravati da tossicità metabolica e cardiovascolare e da un elevato pill burden (1). Darunavir (DRV), PI di seconda generazione in uso da 15 anni, è disponibile anche nella formulazione a singola compressa darunavir/cobicistat/emtricitabina/tenofovir alafenamide (D/C/F/TAF) per il trattamento dei pazienti con HIV, sia ART-naive che ART-experienced.
L'efficacia e la sicurezza di D/C/F/TAF sono state dimostrate negli studi clinici randomizzati AMBER (ART-naive) ed EMERALD (ART-experienced in soppressione virologica), in cui elevate percentuali di PLWH hanno rispettivamente raggiunto (91,4%) o mantenuto (97,5%) la soppressione virale (2-3).
Nonostante negli ultimi anni la scelta del “terzo farmaco” sia progressivamente virata sugli inibitori delle integrasi (INSTI) per i soggetti ART-naive, darunavir è ancora raccomandato dalle linee guida internazionali (4-5) sulla base di alcune caratteristiche, in particolare per l’elevata barriera genetica: è infatti specificamente raccomandato in situazioni difficili, come in mancanza del test di resistenza al genotipo (GRT) o quando si sospetti una scarsa aderenza da parte del paziente (6).
D/C/F/TAF rappresenta anche una valida opzione nell’ottica della strategia di rapid start, in mancanza di un test genotipico o della valutazione dell’HLA-B*57:01 (7-8) e con la combinazione in singola compressa (single tablet regimen, STR), garantisce lo scenario migliore in termini di semplificazione terapeutica.
L'esposizione ai boosted-PI è stata tuttavia associata ad un peggioramento del profilo metabolico ma, per contro, DRV non sembra essere associato all’aumento di peso (9) né agli eventi avversi neuropsichiatrici tipici degli INSTI (10).
Lo studio
I ricercatori della coorte ICONA hanno raccolto informazioni sulla numerosità e sulle caratteristiche dei soggetti che hanno iniziato D/C/F/TAF in un contesto real world, nonché identificato i predittori della scelta di questo regime terapeutico.
È stato condotto uno studio trasversale osservazionale basato sui dati della coorte, che ha incluso PLWH adulti (≥18 anni) che, da gennaio 2017 a novembre 2020, hanno iniziato da ART-naive il regime D/C/F/TAF, o un regime basato su F/TAF + INSTI (F/TAF/DTG, F/TAF/BIC o F/TAF/EVG/cobi) - o F/TAF + NNRTI (F/TAF/RPV), - o il regime dual 3TC/DTG, oppure che sono passati per la prima volta a D/C/F/TAF da qualsiasi altro regime, indipendentemente dalla viremia al momento dello switch.
Gli obiettivi erano identificare i predittori di scelta di D/C/F/TAF (in regime singola o multi pillola) nei soggetti ART-naive rispetto a ciascuno degli altri gruppi considerati, e valutare i predittori di switch a questo regime nei pazienti provenienti da regimi senza boosted-DRV.
Dal punto di vista metodologico, sono state descritte le caratteristiche della popolazione in studio al momento dell’inizio di D/C/F/TAF, e confrontate mediante test Chi-quadrato e Kruskal-Wallis dopo stratificazione per regime di inizio nel gruppo ART-naive e per regime di provenienza nel gruppo ART-experienced. Sono stati costruiti modelli di regressione logistica univariata e multivariata per identificare i fattori associati alla probabilità di iniziare D/C/F/TAF vs. (i) 3TC/DTG o (ii) F/TAF + INSTI o (iii) F/TAF/RPV nel gruppo ART-naive e per identificare i fattori associati al passaggio a D/C/F/TAF senza precedente esposizione a boosted-DRV nei pazienti ART-experienced.
Risultati nei pazienti ART-naive
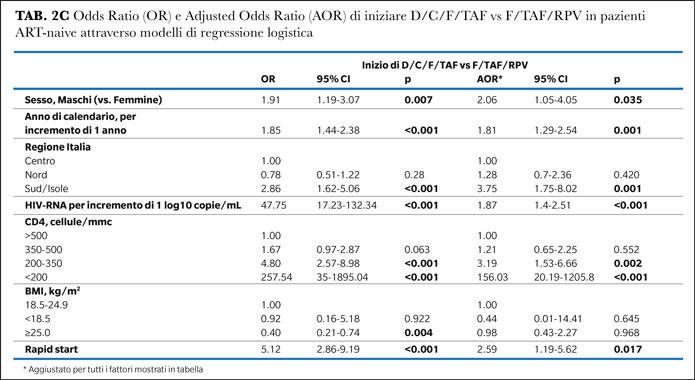
2.050 soggetti ART-naive hanno soddisfatto i criteri di inclusione: 289 (14.1%) hanno iniziato il regime D/C/F/TAF, 238 (11,6%) 3TC/DTG, 1.365 (66.6%) F/TAF + INSTI e 158 (7.7%) F/TAF/RPV. L'età mediana dei soggetti era di 40 anni, con 83.7% maschi e 73.3% italiani. La conta dei CD4 mediana era di 337 cellule/mmc, l'HIV-RNA mediano era 4.89 log10 copie/mL. L’11% dei pazienti aveva una diagnosi di AIDS. Il 31% dei pazienti ha iniziato la ART entro 14 giorni dalla diagnosi di HIV (rapid start) e il 55.9% con una STR. Sono state identificate significative differenze tra i 4 gruppi di pazienti (Tabella 1).
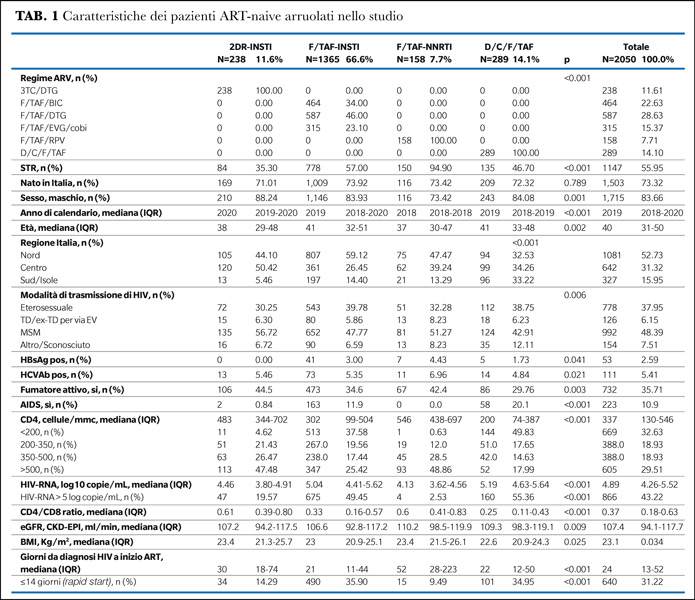
I principali predittori indipendenti dell’inizio del regime D/C/F/TAF vs 3TC/DTG erano la presenza di AIDS alla diagnosi, un HIV-RNA >100.000 copie/mL, una conta dei CD4 <200 cellule/mmc.
I soggetti con D/C/F/TAF avevano una maggiore probabilità di rapid start rispetto a 3TC/DTG. Una minore probabilità di iniziare D/C/F/TAF vs 3TC/DTG è stata osservata negli anni più recenti. I pazienti trattati presso centri del Sud Italia avevano una maggiore probabilità di iniziare D/C/F/TAF rispetto a quelli del Centro Italia (Tabella 2A).
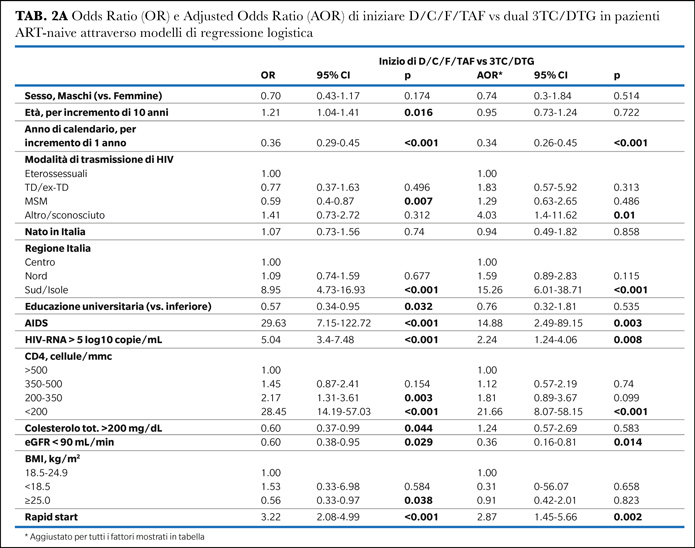
I principali predittori indipendenti dell'avvio di D/C/F/TAF rispetto ai soggetti che iniziavano F/TAF + INSTI erano la diagnosi di AIDS e la conta dei CD4 <200 cellule/mmc (vs >500). Nessuna differenza è stata osservata riguardo all’HIV-RNA basale. Una minore probabilità di iniziare D/C/F/TAF rispetto a F/TAF-INSTI è stata osservata negli ultimi anni e in pazienti sottopeso. Ancora una volta, in confronto ai PLWH in-care nelle unità del Centro Italia, i PLWH seguiti nei centri del Sud Italia hanno mostrato una maggiore probabilità di iniziare D/C/F/TAF, mentre i centri del Nord Italia mostravano una minore probabilità (Tabella 2B).
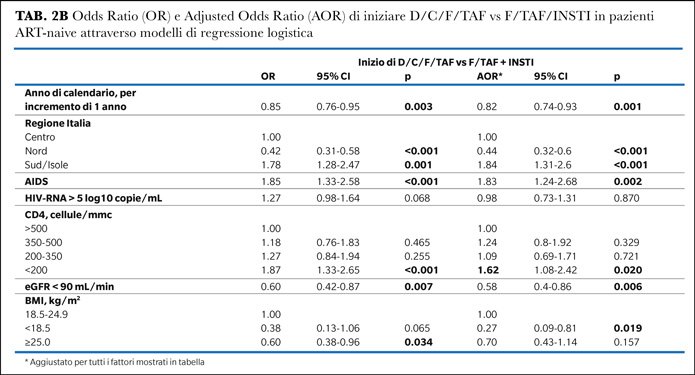
I predittori indipendenti di inizio di D/C/F/TAF rispetto a F/TAF/RPV erano: sesso maschile, conta dei CD4 < 200 cellule/mmc o tra 200 e 350 cellule/mmc. I pazienti con HIV-RNA più elevato all’inizio della ART avevano una maggiore probabilità di iniziare il regime basato su DRV. Si è confermata la predisposizione dei centri di malattie infettive del Sud Italia all’inizio di D/C/F/TAF rispetto al Centro Italia e dell’inizio preferenziale in rapid start. Rispetto a F/TAF/RPV, D/C/F/TAF è stata iniziata in anni più recenti (Tabella 2C).
Risultati nei pazienti ART-experienced
685 PLWH ART-experienced sono passati per la prima volta a D/C/F/TAF, indipendentemente dal livello di HIV-RNA allo switch: di questi, 234 (34.2%) in STR. Nell'80% dei soggetti l'HIV-RNA più recente prima dello switch era < 50 copie/mL. L'età mediana era di 47 anni (IQR 37-54), il 79.5% maschi, il 77.8% italiani; il 13.6% era co-infetto da HCV e l’8.2% da HBV. La conta mediana delle cellule CD4 al basale era di 568 cellule/mmc (358-793) e il rapporto mediano CD4/CD8 era di 0.70 (0.41-1.07). Il 20.4% dei pazienti aveva una precedente diagnosi di AIDS, e il 10.1% dei pazienti presentava malattie renali croniche. In mediana i soggetti avevano 2 precedenti linee di terapia prima di passare a D/C/F/TAF (1-4) in una mediana di 4.5 anni.
Il 69% dei pazienti proveniva da un regime basato su boosted-DRV, e il 16.2% aveva almeno 1 fallimento virologico prima dello switch. Il 55% passava a D/C/F/TAF per semplificazione terapeutica, l’8% per fallimento e il 15% per tossicità del regime precedente.
Su 685 PLWH ART-experienced, 212 (31%) non avevano boosted-DRV nel regime precedente; nell’analisi multivariata i predittori indipendenti del passaggio a D/C/F/TAF da un regime senza boosted-DRV erano gli anni di calendario più recenti (per 1 anno in più, AOR=2.47; 95% CI 2.02-3.02), l'essere donna (AOR=1.80; 95% CI 1.06-3.06), la nazionalità non italiana (AOR=1.62; 95% CI 1.02-2.60), l’avere HIV-RNA > 50 copie/mL al momento dello switch (AOR=2.18; 95% CI 1.35-3.51), un numero maggiore di precedenti fallimenti virologici (>1 vs 0, AOR=1.80; 95% CI 1.01-3.21). Le PLWH in cura nei centri del Nord Italia avevano una probabilità 1.83 volte maggiore di iniziare D/C/F/TAF da regimi senza boosted-DRV rispetto al Centro Italia (95% CI 1.20-2.79).
Conclusioni
Nella coorte ICONA, dopo gennaio 2017, il regime D/C/F/TAF è stato usato come terapia di prima linea nel 16% di tutti i regimi triplici a base di F/TAF (14% considerando anche il dual regimen 3TC/DTG), il 46,7% delle volte in singola compressa.
D/C/F/TAF è stato scelto preferenzialmente come prima linea per i soggetti advanced naive; infatti, sia l'AIDS che la conta di CD4 <200 cellule/mmc sono predittori di inizio del regime rispetto a tutti gli altri gruppi analizzati.
Inoltre, l'uso di D/C/F/TAF in prima linea è risultato preferito nei centri del Sud Italia rispetto al Centro Italia in tutti i gruppi; una causa potrebbe essere la diversa disponibilità del test di resistenza genotipica. Mentre i centri del Nord Italia hanno mostrato una minore probabilità di iniziare la ART con D/C/F/TAF vs F/TAF + INSTI, in confronto ai centri del Centro Italia, non si è riscontrata nessuna differenza per gli altri gruppi. Rispetto a 3TC/DTG e F/TAF/RPV, il regime con D/C/F/TAF è stato preferito nei pazienti con carica virale più alta e come strategia di rapid start.
685 soggetti ART-experienced sono passati a D/C/F/TAF, il 34.2% alla STR; il 20% dei pazienti inclusi aveva carica virale rilevabile al momento dello switch e il 69% proveniva da un precedente regime con boosted-DRV. Questo regime è stato considerato un'opzione valida nelle donne, nei pazienti non italiani, nei soggetti con una lunga storia di ART, con precedenti fallimenti virologici o con viremia non soppressa al momento del passaggio. I punti di forza di questo studio sono l’elevata dimensione del campione e l'impostazione real-world che ci ha permesso di indagare i modelli di prescrizione di D/C/F/TAF nei pazienti ART-naive. Non avendo identificato gruppi di confronto diversi da D/C/F/TAF nella popolazione ART-experienced, non è stato possibile indagare il ruolo di altri importanti predittori d scelta del regime di switch.
- Hatleberg CI, Ryom L, Sabin C. Cardiovascular risks associated with protease inhibitors for the treatment of HIV. Expert Opin Drug Saf. 2021; 20(11):1351-1366.
- Eron JJ, Orkin C, Gallant J, et al. A week-48 randomized phase-3 trial of darunavir/cobicistat/emtricitabine/tenofovir alafenamide in treatment-naive HIV-1 patients. AIDS. 2018; 32(11):1431-1442.
- Orkin C, Molina JM, Negredo E, et al. Efficacy and safety of switching from boosted protease inhibitors plus emtricitabine and tenofovir disoproxil fumarate regimens to single-tablet darunavir, cobicistat, emtricitabine, and tenofovir alafenamide at 48 weeks in adults with virologically suppressed HIV-1 (EMERALD): a phase 3, randomised, non-inferiority trial. Lancet HIV. 2018; 5(1):e23-e34.
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. Department of Health and Human Services. https://clinicalinfo.hiv.gov/en/guidelines/adult-and-adolescent-arv.
- European AIDS Clinical Society. EACS Guidelines 11.0 October 2021. https://www.eacsociety.org/media/final2021eacsguidelinesv11.0_oct2021.pdf
- Lathouwers E, Wong EY, Luo D, et al. HIV-1 resistance rarely observed in patients using darunavir once-daily regimens across clinical studies. HIV Clin Trials. 2017; 18:196-204.
- Huhn GD, Gordon Crofoot G, Ramgopal M, et al. Darunavir/Cobicistat/Emtricitabine/Tenofovir Alafenamide in a Rapid-Initiation Model of Care for Human Immunodeficiency Virus Type 1 Infection: Primary Analysis of the DIAMOND Study, Clinical Infectious Diseases. 2020; 71(12):3110-3117.
- Ford N, Migone C, Calmy A, et al. Benefits and risks of rapid initiation of antiretroviral therapy. AIDS. 2018; 32(1):17-23.
- Emond B, Rossi C, Côté-Sergent A, et al. Weight Change and Predictors of Weight Change Among Patients Initiated on Darunavir/Cobicistat/Emtricitabine/Tenofovir Alafenamide or Bictegravir/Emtricitabine/Tenofovir Alafenamide: A Real-World Retrospective Study. J Health Econ Outcomes Res. 2021; 8(1):88-98.
- Bushen J, Luo D, Simonson RB, et al. Darunavir/Cobicistat/Emtricitabine/Tenofovir Alafenamide (D/C/F/TAF) in Treatment-naïve (AMBER) and Virologically Suppressed (EMERALD) Patients With Neurologic and/or Psychiatric Comorbidities: Week 96 Subgroup Analysis. 23rd International AIDS Conference, AIDS 2020 Virtual, 06-10 July 2020. Poster PDB0202.







