L’elevato rischio di progressione clinica, di morbilità e di mortalità che grava sulle persone PLWH heavily treatment-experienced (HTE) è la ragione per cui è stato concepito il Registro PRESTIGIO, raccolta osservazionale, prospettica, multicentrica di dati clinici e virologici e di campioni di PLWH-HTE regolarmente seguiti presso diversi Centri italiani. Il Registro si occupa infatti di caratterizzare le PLWH con documentata resistenza alle principali quattro classi di farmaci antiretrovirali (NRTI, NNRTI, PI, INSTI) e di creare un ambiente interattivo e multidisciplinare per migliorarne complessivamente la gestione, obiettivi di cui si è reso conto durante la seconda edizione del PRESTIGIO Registry Meeting (RING), descrivendo lo stato dell’arte nel campo della resistenza multifarmaco all’HIV e la gestione di questa fragile popolazione nella vita reale.
HIV e le strategie di prevenzione, trattamento e cura con bNAbs
Mirko Compagno, Policlinico Tor Vergata, Roma
Jovana Milić, Università di Modena e Reggio Emilia
Gli anticorpi neutralizzanti ad ampio spettro (bNAbs – broadly neutralizing antibodies) nel contesto dell’immunodeficienza umana (HIV) sono gli anticorpi in grado di neutralizzare i ceppi HIV appartenenti a diversi cladi, attraverso il legame a regioni conservate della glicoproteina dell’involucro virale (Env). Queste regioni includono il sito di legame al CD4, il supersito del glicano V3, l’interfaccia gp120-gp41 e la regione esterna prossimale alla membrana (MPER - membrane-proximal external region). I bNAbs possono pertanto essere utilizzati nelle strategie di prevenzione, trattamento e cura dei pazienti con infezione da HIV (PWH).
Tramite la somministrazione iniettiva a lunga durata d’azione (long-acting), i bNAbs rappresentano un’opzione altamente desiderabile nell’ambito della prevenzione dell’infezione. Studi clinici hanno dimostrato che l’infusione di bNAbs può conferire protezione contro l’acquisizione dell’HIV. Alcuni trial hanno mostrato che l’infusione del bNAb VRC01 ha fornito una protezione del 75% contro i ceppi di HIV sensibili all’anticorpo. Tuttavia, la protezione complessiva contro l’acquisizione dell’HIV è stata limitata, sottolineando la necessità di combinazioni di bNAbs per migliorare l’efficacia.
La combinazione dei bNAbs Teropavimab e Zinlirivimab (Tab/Zab) è in fase di sviluppo per il trattamento e la cura dei pazienti con infezione da HIV. Sono in corso studi di associazione tra la combinazione Tab/Zab ad azione prolungata e l’inibitore del capside Lenacapavir (LEN) con una somministrazione ogni 6 mesi (ultra long-acting).
In analisi di suscettibilità fenotipica, uno studio osservazionale multicentrico del Registro PRESTIGIO (Pazienti con infezione da HIV-1 con RESitenza agli inibitori della Trascrittasi inversa, dell'InteGrasi e della Proteasi Virale) ha dimostrato che il 76% dei pazienti aveva un’infezione sostenuta da un virus suscettibile a TAB, il 50% a ZAB e il 41% ad entrambi i bNAbs. Il 15% dei pazienti aveva invece infezione da un virus resistente a entrambi gli anticorpi monoclonali.
Gli studi hanno inoltre dimostrato che, quando usati in combinazione, i bNAbs sono efficaci e sicuri, pertanto possono rappresentare una strategia nei pazienti con poche opzioni di trattamento. Tuttavia, le varianti resistenti possono emergere anche in corso di terapia con bNAbs in combinazione, rendendo necessario un monitoraggio continuo e l’adattamento delle strategie di trattamento.
Stanno emergendo dati promettenti quando i bNAbs vengono utilizzati nelle fasi iniziali dell’infezione in associazione alla ART, nei pazienti viro-soppressi in ART stabile e all’interruzione della terapia (post-ART). Un numero crescente di pazienti in grado di controllare l’infezione a lungo termine dopo sospensione della ART (post-treatment controller) è ora identificato negli studi dei bNAbs e molti studi hanno dimostrato come gli anticorpi monoclonali ritardino il tempo di rebound virologico dopo sospensione di terapia.
Farmacologia dei nuovi farmaci
Alice Ianniello, Ospedale Amedeo di Savoia, ASL Città di Torino
Francesca Panza, Azienda Ospedaliero-Universitaria Senese, Siena
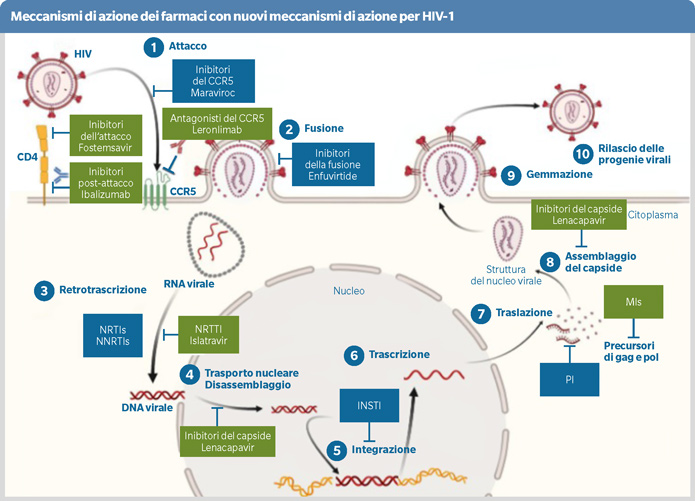
Le persone con infezione da HIV e limitate opzioni terapeutiche (LTO) sono una categoria di pazienti con complessi problemi di farmacocinetica. Sono pazienti highly treatment experienced (HTE), con problematiche di comorbidità/polifarmacia, assorbimento e drug-to-drug interactions (DDIs). In quanto tali, rappresentano la categoria target dei farmaci con nuovi meccanismi d’azione (MoAs): Lenacapavir (LEN), Fostemsavir (FTR), Islatavir (ISL), Ibalizumab (IBA) e anticorpi monoclonali neutralizzanti (bnAbs).
Dal punto di vista farmacocinetico:
- Lenacapavir è un inibitore del capside, iniettabile, a lunga durata d’azione ed elevata potenza. Presenta una buona farmacocinetica e un gestibile profilo di DDIs. Resistance associated mutations a LEN sono state osservate solo in caso di inadeguata aderenza/struttura dell’optimized background regimen. Non è necessario un aggiustamento della dose in caso di insufficienza renale/epatica anche moderata.
- Fostemsavir, pro-farmaco idrosolubile convertito nella forma attiva Temsavir a livello intestinale, è inibitore delle proteine implicate nell’adesione di HIV alla superficie cellulare. Presenta discreta biodisponibilità ed emivita. È substrato di CYP3A4 ma presenta un buon profilo di DDIs (controindicata solo la co-somministrazione con rifampicina per riduzione notevole della concentrazione di Temsavir). Non necessario un aggiustamento della dose nei soggetti con insufficienza epatica/renale.
- Islatravir è un inibitore nucleosidico della traslocazione della trascrittasi inversa ad alta barriera genetica e lunga emivita (78-120h). Potente anche a basse dosi. Linfocitotossico a dosi elevate. Efficace e sicuro in somministrazione per os settimanale in associazione a LEN. Basso potenziale di DDIs.
I buoni profili farmacocinetici e le minime interazioni farmacologiche dei nuovi farmaci, rappresentano una grande potenzialità per migliorare l’efficacia e la tollerabilità dei regimi terapeutici nei soggetti HTE con LTO.
Significato e gestione della low level viremia
Riccardo Lolatto, IRCCS Ospedale San Raffaele, Milano
Silvia Cretella, IRCCS AOU di Bologna, Policlinico Sant’Orsola, Bologna
Davide Laurenda, ASST Spedali Civili - Università degli Studi di Brescia
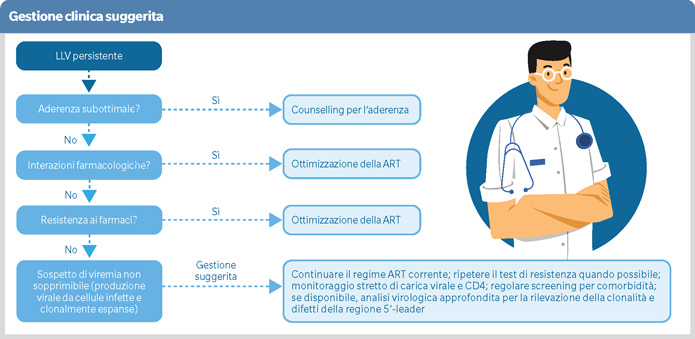
Sebbene non esista un consenso universale, si definisce generalmente come Low level viremia (LLV) la viremia rilevabile al di sotto della soglia di fallimento. L’OMS ad esempio considera LLV la carica virale tra le 50 e le 1000 copie/mL, mentre altre organizzazioni, come IAS ed EACS, propongono una soglia tra le 50 e le 200 copie/mL.
Studi come quelli di Hermans e coll. (Lancet Inf. Dis. 2018) e di Swenson e coll. (AIDS 2014) hanno dimostrato che la LLV aumenta il rischio di fallimento virologico e di resistenza ai farmaci. Una coorte canadese ha ad esempio evidenziato come il 30% delle persone con LLV sviluppi resistenza ai farmaci antiretrovirali (ART) durante il primo episodio di LLV. Inoltre, la LLV risulta essere associata a un maggior rischio di evoluzione virologica, specialmente nei regimi non basati su inibitori dell’integrasi (INSTI). Studi recenti hanno anche esplorato l’associazione tra LLV e attivazione immunitaria e aumento del grado di infiammazione, mostrando come la LLV risulti essere collegata a un aumento della mortalità per tutte le cause e all’incremento di eventi non-AIDS relati.
Alla luce di queste evidenze diventa di grande importanza per il clinico una gestione oculata della LLV, andando a valutare approfonditamente: regime e dosaggio dei farmaci con una revisione delle linee terapeutiche storiche e dei test di resistenza; aderenza del paziente, valutandone tollerabilità, stigma o proponendo test di farmacocinetica; infine le interazioni farmacologiche, verificando anche eventuali comorbidità.
In sintesi, la LLV è un fenomeno complesso che richiede una gestione attenta e personalizzata. È fondamentale riconoscere i segnali di avvertimento precoce per prevenire il fallimento virologico e la resistenza ai farmaci. Ulteriori ricerche e linee guida globali sono comunque necessarie per migliorare la gestione clinica della LLV.
Il test di resistenza fenotipico: sì o no?
Tommaso Clemente, Rebecka Papaioannu Borjesson, IRCCS Ospedale San Raffaele, Università Vita-Salute San Raffaele, Milan
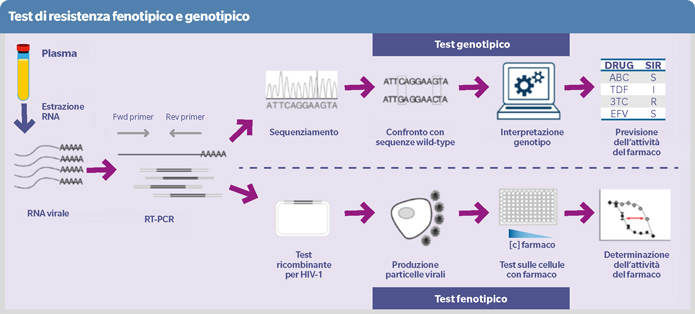
Al contrario del test genotipico, che predice la suscettibilità di HIV agli antiretrovirali (fenotipo) in base alle mutazioni di resistenza (genotipo), il test di resistenza fenotipico misura direttamente la suscettibilità agli antiretrovirali in presenza di specifici pattern di mutazioni. Il test genotipico si basa sul sequenziamento dei geni coinvolti nella farmacoresistenza, mentre il test fenotipico prevede l’inserimento in un vettore di una regione del genoma virale prelevato da un campione clinico e valuta in vitro la replicazione virale in presenza di diluizioni seriate di antiretrovirali (1-3).
Per valutare la suscettibilità fenotipica si utilizza il Fold-Change (FC), rapporto tra la concentrazione inibente il 50% della replicazione (IC50) del virus analizzato e quella del virus wild-type (1: piena suscettibilità; >1: ridotta suscettibilità; >>1: resistenza ad alto grado). Si considerano anche il Biological Cut-Off (BCO), valore medio di FC negli individui naive alla terapia sommato a 2 deviazioni standard (FCClinical Cut-Off (CCO), basati sulla risposta virologica negli studi clinici (FC>Lower CCO: risposta ridotta; FC>Upper CCO: risposta assente).
Il fenotipo differisce dal genotipo per tempi di esecuzione, costi e difficoltà tecnica più elevati. Inoltre, il tasso di fallimento di amplificazione di frammenti genomici lunghi è elevato, soprattutto in caso di bassa viremia; i virus ricombinanti possono avere una bassa capacità di replicazione con fallimento dell’infezione e/o replicazione nelle cellule; si possono perdere alcune mutazioni nei passaggi in colture cellulari.
Nonostante tali limitazioni, il test fenotipico è particolarmente utile in specifiche condizioni, quali la valutazione di pattern di mutazioni complessi o inusuali (4), la caratterizzazione di nuovi farmaci (5-7) e il supporto alle decisioni terapeutiche in persone con HIV multiresistente (8-9) (anche in soppressione virologica).
- Phenosense, Monogram Biosciences, South San Francisco, CA.
- Saladini F, Giannini A, Boccuto A, et al. Agreement between an in-house replication competent and a reference replication defective recombinant virus assay for measuring phenotypic resistance to HIV-1 protease, reverse transcriptase, and integrase inhibitors. J Clin Lab Anal. 2018; 32(1):e22206.
- Saladini F, Vicenti I. Role of Phenotypic Investigation in the Era of Routine Genotypic HIV-1 Drug Resistance Testing. Future Virology. 2016; 11(11):731–744.
- Saladini F, Giammarino F, Maggiolo F, et al. Residual phenotypic susceptibility to doravirine in multidrug-resistant HIV-1 from subjects enrolled in the PRESTIGIO Registry. Int J Antimicrob Agents. 2023; 61(3):106737.
- Giammarino F, Saladini F, Tavio M, et al. In vitro activity of islatravir against HIV-1 mutants harboring multiple NRTI resistance mutations. Presented at European Meeting on HIV & Hepatitis 2020, virtual, 28-30 October 2020.
- Paletti C, et al. Comparative analysis of islatravir and tenofovir in vitro activity in NRTI resistant HIV-1 harboring the M184V/I mutation. Presented at European Meeting on HIV & Hepatitis 2024, Barcelona, 22-24 May 2024.
- Selzer L, VanderVeen LA, Parvangada A, et al. Susceptibility Screening to bNAbs Teropavimab (GS-5423) and Zinlirvimab (GS-2872) in ART-Suppressed Participants. Presented at CROI 2023, Seattle, 19-22 February 2023.
- Panza F, Saladini F, Bartolini N, et al. PRESTIGIO RING "a 59-year-old man with multidrug resistant HIV-1 infection failing a regimen including dolutegravir, rilpivirine, atazanavir/cobicistat: successful treatment tailoring based on genotypic and phenotypic resistance tests". New Microbiol. 2024; 47(1):116-122.
- Clemente T, Canetti D, Messina E, et al. Long-term outcome in a person with pandrug-resistant HIV: the added value of a multidisciplinary approach. JAC Antimicrob Resist. 2024; 6(3):dlae074.
NGS e Whole genome sequencing (WGS): il dilemma del cut-off
Valeria Bono, ASST Santi Paolo e Carlo, Università degli Studi di Milano
Luca Pipitò, Policlinico Universitario "Paolo Giaccone", Palermo
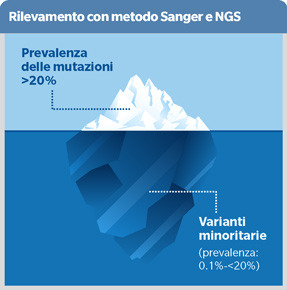 Il sequenziamento dell’HIV RNA plasmatico ha supportato e continua a supportare la scelta della terapia antiretrovirale in diversi contesti. Il metodo Sanger ci consente di vedere solo le mutazioni delle varianti virali, che presentano una prevalenza di almeno il 20%, sequenziando una sola molecola di DNA per volta e utilizzando didesossinucleotidi marcati con un fluorescente che terminano la sintesi del DNA quando incorporati e generano frammenti DNA di lunghezze diverse, che vengono poi separati mediante elettroforesi capillare. Questo 20% in realtà rappresenta solo la punta di un iceberg. Oggi con l’avvento del next generation sequencing (NGS) è possibile vedere cosa sta al di sotto. L’NGS utilizza un sequenziamento in parallelo e genera grandi moli di dati con una profondità tale da permettere il rilevamento di varianti minoritarie con una prevalenza fino a meno dell’1%. I risultati ottenuti vengono poi interpretati tramite i database disponibili (Stanford, HyDra Web, e PASEQ). Esistono diverse tecnologie per l’NGS (Illumina, Thermo Fisher, Pacific Biosciences, Oxford Nanopore Technologies), ma un solo KIT in commercio (Sentosa SQ HIV-1 Genotyping Assay) e di conseguenza i laboratori spesso utilizzano test sviluppati internamente. È fondamentale definire un cut-off tecnico da utilizzare per ridurre il rischio di errori e questo ad oggi si colloca intorno al 5%. Scendendo al di sotto di questo limite, aumentano in modo esponenziale gli errori dovuti a codoni di stop, mutazioni insolite e sequenze APOBEC. Più spinosa è la questione del cut-off clinico per il quale non vi sono forti evidenze se le mutazioni che interessano le varianti minoritarie possano influire sulla scelta terapeutica, ad eccezione di alcuni studi in cui queste sembrerebbero impattare esclusivamente sui regimi basati su NNRTI. Con l’NGS è possibile il sequenziamento dell’intero genoma virale (WGS) e si può focalizzare l’attenzione su altre regioni come env e gag, utili per i nuovi farmaci, migliorare l’analisi filogenetica e individuare genotipi ipervirulenti.
Il sequenziamento dell’HIV RNA plasmatico ha supportato e continua a supportare la scelta della terapia antiretrovirale in diversi contesti. Il metodo Sanger ci consente di vedere solo le mutazioni delle varianti virali, che presentano una prevalenza di almeno il 20%, sequenziando una sola molecola di DNA per volta e utilizzando didesossinucleotidi marcati con un fluorescente che terminano la sintesi del DNA quando incorporati e generano frammenti DNA di lunghezze diverse, che vengono poi separati mediante elettroforesi capillare. Questo 20% in realtà rappresenta solo la punta di un iceberg. Oggi con l’avvento del next generation sequencing (NGS) è possibile vedere cosa sta al di sotto. L’NGS utilizza un sequenziamento in parallelo e genera grandi moli di dati con una profondità tale da permettere il rilevamento di varianti minoritarie con una prevalenza fino a meno dell’1%. I risultati ottenuti vengono poi interpretati tramite i database disponibili (Stanford, HyDra Web, e PASEQ). Esistono diverse tecnologie per l’NGS (Illumina, Thermo Fisher, Pacific Biosciences, Oxford Nanopore Technologies), ma un solo KIT in commercio (Sentosa SQ HIV-1 Genotyping Assay) e di conseguenza i laboratori spesso utilizzano test sviluppati internamente. È fondamentale definire un cut-off tecnico da utilizzare per ridurre il rischio di errori e questo ad oggi si colloca intorno al 5%. Scendendo al di sotto di questo limite, aumentano in modo esponenziale gli errori dovuti a codoni di stop, mutazioni insolite e sequenze APOBEC. Più spinosa è la questione del cut-off clinico per il quale non vi sono forti evidenze se le mutazioni che interessano le varianti minoritarie possano influire sulla scelta terapeutica, ad eccezione di alcuni studi in cui queste sembrerebbero impattare esclusivamente sui regimi basati su NNRTI. Con l’NGS è possibile il sequenziamento dell’intero genoma virale (WGS) e si può focalizzare l’attenzione su altre regioni come env e gag, utili per i nuovi farmaci, migliorare l’analisi filogenetica e individuare genotipi ipervirulenti.
Verso uno screening precoce delle comorbilità
Giuseppe Gasparro, Scuola di Specializzazione in Malattie Infettive e Tropicali, Firenze
Elisabetta Svizzeretto, Scuola di Specializzazione in Malattie Infettive e Tropicali, Perugia
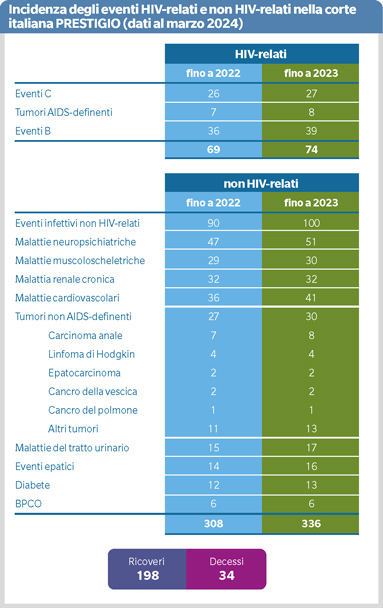 L’aspettativa e la qualità di vita delle persone che vivono con HIV (PLWH) è aumentata, tuttavia, si è assistito all’incremento delle patologie non-AIDS definenti (1). Oggi, eventi cardiovascolari e tumori sono le principali cause di mortalità e morbilità come anche evidenziato nella corte italiana PRESTIGIO (1).
L’aspettativa e la qualità di vita delle persone che vivono con HIV (PLWH) è aumentata, tuttavia, si è assistito all’incremento delle patologie non-AIDS definenti (1). Oggi, eventi cardiovascolari e tumori sono le principali cause di mortalità e morbilità come anche evidenziato nella corte italiana PRESTIGIO (1).
I tumori sono una delle principali cause di morte nei PLWH per cui è necessario agire intervenendo sui fattori di rischio modificabili e sviluppare strategie di screening per la diagnosi precoce. La coinfezione da HPV, cancerogeno per tumori di cervice uterina, ano e testa-collo, è frequente. È fondamentale, quindi, promuovere la vaccinazione contro HPV e lo screening proattivo con metodi molecolari, citologici e clinici, in particolare per uomini che hanno rapporti con uomini (3). Per i tumori polmonari, vari studi incoraggiano l’utilizzo della TC torace a basso dosaggio negli individui ad alto rischio (4). Un’altra sfida è l’incremento di eventi cardiovascolari (CVD), causato dalla combinazione di fattori di rischio sia tradizionali che propri dei PLWH, come l’infiammazione cronica (5). Questi, inoltre, sono spesso più precoci rispetto alla popolazione generale e in individui a basso rischio secondo le scale tradizionalmente usate, che spesso sottostimano il rischio in questa coorte. È necessario, dunque, identificare precocemente gli individui con malattia subclinica, sviluppando strategie preventive e terapeutiche agenti sia su fattori di rischio tradizionali che sull’infiammazione, considerando l’uso delle statine, come mostrato da recenti trial (6), per la loro azione pleiotropica e ipolipemizzante. Nelle persone con maggior rischio cardiovascolare alcune evidenze suggeriscono, inoltre, lo studio delle coronarie.
La nuova sfida da accogliere è, quindi, la prevenzione primaria e secondaria di CVD e tumori, identificando score specifici per questa popolazione e protocolli dedicati per migliorare ulteriormente qualità e aspettativa dei PLWH.
- M S R Weber, J J Duran Ramirez, et al. the Swiss HIV Cohort Study , Time Trends in Causes of Death in People With Human Immunodeficiency Virus: Insights From the Swiss HIV Cohort Study, Clinical Infectious Diseases, 2024; ciae014, https://doi.org/10.1093/cid/ciae014
- Galli L, Parisi MR et al.; PRESTIGIO Study Group. Burden of Disease in PWH Harboring a Multidrug-Resistant Virus: Data From the PRESTIGIO Registry. Open Forum Infect Dis. 2020 Sep 26;7(11):ofaa456. doi: 10.1093/ofid/ofaa456
- Rahel Ghebre et al., State of the Science: Screening, Surveillance, and Epidemiology of HPV-Related Malignancies. Am Soc Clin Oncol Educ Book 41, 377-388(2021). DOI:10.1200/EDBK_325319
- Nierengarten MB. Updated American Cancer Society lung cancer screening guidelines: The new guidelines offer expanded criteria recommended for lung cancer screening based on age, smoking status, and smoking history. Cancer. 2024 Mar 1;130(5):656-657. doi: 10.1002/cncr.35223
- Althoff KN, Stewart C et al., The forecasted prevalence of comorbidities and multimorbidity in people with HIV in the United States through the year 2030: A modeling study. PLoS Med. 2024 Jan 12;21(1):e1004325. doi: 10.1371/journal.pmed.1004325
- Grinspoon SK, Fitch KV et al.; REPRIEVE Investigators. Pitavastatin to Prevent Cardiovascular Disease in HIV Infection. N Engl J Med. 2023 Aug 24;389(8):687-699. doi: 10.1056/NEJMoa2304146







