La cirrosi scompensata rappresenta, insieme all’insufficienza epatica, lo stadio finale delle varie forme di epatopatia cronica ed è associata a circa il 2.5% delle morti a livello globale (1,2). Negli ultimi decenni, i ricoveri ospedalieri dovuti a cirrosi scompensata sono incrementati in modo significativo se confrontati con altre patologie croniche, come ad esempio lo scompenso cardiaco o la broncopneumopatia cronica ostruttiva, con inoltre durate di degenza superiori e outcome peggiori (3).In aggiunta, si stima per la prossima decade un costante aumento dei ricoveri e dei decessi per cirrosi epatica scompensata (4), con un ruolo preponderante della patologia correlata all'alcol e alla steatosi epatica associata a disfunzione metabolica (MASLD) (5,6).
I risultati di uno studio prospettico
È ampiamente riconosciuto che l'insorgenza di un episodio di scompenso rappresenta un momento cruciale nella storia clinica del paziente affetto da malattia epatica, influendo significativamente sulla prognosi. In particolare, lo scompenso ascitico è l'evento che incide maggiormente in tal senso, con una mortalità del 30% a 5 anni (7). In questo contesto, lo scompenso acuto (acute decompensation, AD) è definito come lo sviluppo repentino di una complicanza tale da necessitare il ricovero ospedaliero (es: sviluppo di ascite di grado 2 o 3 in meno di 14 giorni, encefalopatia epatica, sanguinamento gastrointestinale, infezione batterica). Nella pratica clinica quotidiana è tuttavia esperienza comune che non tutti i pazienti manifestano un episodio di scompenso di una gravità tale da richiederne l’ospedalizzazione; in molti casi, infatti, lo sviluppo di una complicanza può avvenire in maniera graduale, comportando una gestione ambulatoriale talvolta piuttosto complessa (8).
L’interessante lavoro di Tonon e coll., di recente pubblicazione su Journal of Hepatology, ha analizzato, attraverso l’analisi prospettica di oltre 600 pazienti ambulatoriali arruolati dal 2003 al 2021 in due centri di terzo livello (Padova e Milano), le differenze in termini prognostici delle diverse modalità di insorgenza dello scompenso epatico (9). Escludendo i pazienti con storia di pregresso scompenso negli ultimi 6 mesi, comorbidità cardio-polmonari significative, epatocarcinoma o altre neoplasie extraepatiche, i pazienti sono stati seguiti per un follow-up mediano di 5 anni. Gli Autori hanno distinto i pazienti in 3 categorie:
- pazienti senza episodi di scompenso (no decompensation, ND)
- pazienti con sviluppo non acuto di ascite di grado 2 o encefalopatia epatica di grado 1 o 2 gestiti esclusivamente in regime ambulatoriale (non-acute decompensation, NAD)
- pazienti con episodi di AD, intesi come comparsa di sanguinamento gastrointestinale, encefalopatia epatica grado 3 o 4 oppure ascite complicata da peritonite batterica spontanea e/o da insufficienza renale, tutti richiedenti l’ospedalizzazione.
Complessivamente, l’epatite C rappresentava l'eziologia principale (44%), seguita dall'alcol (30%) e dalla cirrosi associata a MASLD (23%). I pazienti, prevalentemente di sesso maschile (65%) e con un'età media di 57 anni, erano caratterizzati da una funzione epatica ancora relativamente conservata (Child-Pugh e MELD score mediani rispettivamente di 5 e 8 punti); infine, il 29% assumeva beta-bloccanti non selettivi (NSBBs) in profilassi primaria.
Il 75% dei pazienti (463) non ha mai sviluppato scompenso, 69 pazienti (11%) hanno sviluppato NAD e 85 (14%) AD. I pazienti del gruppo NAD hanno manifestato ascite come causa di scompenso nel 78% dei casi mentre nei pazienti del gruppo AD l’ascite, l’encefalopatia e il sanguinamento gastrointestinale hanno rappresentato la causa di scompenso rispettivamente nel 34%, 33% e 27% dei casi. Inoltre, quasi la metà (29/69, 42%) dei pazienti con NAD ha sviluppato un episodio di AD dopo un follow-up mediano di circa un anno, evidenziando una chiara connessione tra i due percorsi clinici.
Dal punto di vista della mortalità, essa è risultata, come atteso, nettamente inferiore nei pazienti ND (39/463, 8%) rispetto sia ai pazienti NAD (12/40, 30%) sia ai pazienti AD (60/114, 53%), con una mortalità per cause epatiche del 44%, 58% e 76% nei tre gruppi (Figura 1).
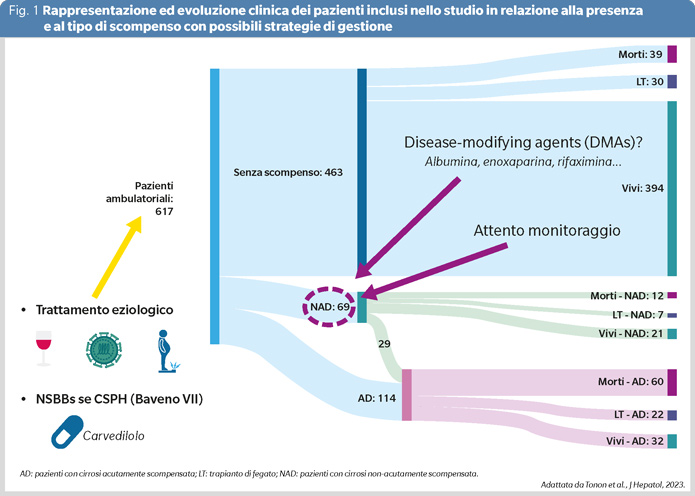
All’analisi multivariata, i fattori predittivi di NAD e di AD sono risultati il punteggio MELD e la profilassi con NSBBs, quest’ultima probabilmente indicativa della presenza di ipertensione portale clinicamente significativa (CSPH), mentre l’efficacia del trattamento della causa responsabile dell’epatopatia si è rivelata un fattore protettivo per entrambi i gruppi.
Gli Autori concludono ribadendo che lo scompenso nella cirrosi epatica si può manifestare in due modalità differenti, NAD e AD, con impatto diverso sulla mortalità, e che ipazienti NAD dovrebbero essere monitorati attentamente per prevenire lo sviluppo di AD.
Implicazioni per la clinica
Dalla ricerca di Tonon e coll., emerge dunque l'importanza non solo del passaggio da cirrosi non scompensata (ND) ad acutamente scompensata (AD), ma soprattutto da ND a non-acutamente scompensata (NAD) e quindi da NAD a AD (con mortalità quasi raddoppiata in quest’ultimo caso). In ragione del fatto che il passaggio da ND ad AD è spesso imprevedibile (pertanto solo una piccola quota di tali episodi potrebbe essere efficacemente prevenuta), diviene dunque cruciale concentrarsi sul paziente NAD, che è gravato sia da alta probabilità di sviluppare AD che da una significativa mortalità.
Si pone quindi la questione di come identificare i pazienti che hanno maggiori probabilità di evoluzione sfavorevole. Il MELD score (così come il punteggio Child-Pugh), sebbene indicato dallo studio come fattore predittivo sia di NAD/AD sia di mortalità, sembra offrire un’utilità limitata: i pazienti ND presentavano infatti uno score MELD mediano di 8, quelli NAD di 10 e quelli AD di 9, punteggi tutti piuttosto bassi che rendono difficile un orientamento pragmatico. Diverrà allora importante poter disporre in questo contesto clinico di test non invasivi e caratterizzati da una maggiore granularità in grado di identificare i pazienti più a rischio, soprattutto all’interno del gruppo NAD. In questi pazienti, pare ragionevole ipotizzare per un prossimo futuro, da una parte un follow-up “più stretto” (anticipando i controlli ematochimici e le visite ambulatoriali) e, dall’altra, l’introduzione o lo sviluppo di farmaci mirati a modificare direttamente il corso della malattia epatica. Questi farmaci, noti come i disease-modifying agents (DMAs; ne sono un esempio, tra quelli già noti, le infusioni periodiche di albumina, la somministrazione cronica di enoxaparina e di antibiotici scarsamente assorbibili), potrebbero dimostrarsi particolarmente vantaggiosi in tale categoria di pazienti ed è pertanto auspicabile l’avvio di studi clinici volti a indagarne l’efficacia in questo contesto (10). Infine, ancora una volta viene ribadito come una terapia eziologica efficace (eradicazione virale, astensione dall’alcol) rappresenti un elemento determinante nella cura di questi pazienti.
Ci sembrano importanti alcune precisazioni circa il valore di questi risultati nel contesto clinico attuale. Nonostante lo studio si distingua per l'ampio periodo di arruolamento, esso è inficiato da un numero limitato di pazienti (154) che hanno sviluppato scompenso clinico. Inoltre, in questi ultimi 20 anni si è assistito ad un cambiamento radicale non solo nell’eziologia della cirrosi ma anche nella gestione terapeutica di questi pazienti. Per quanto riguarda il primo punto, si è registrata una significativa diminuzione dell'epatopatia virale rispetto all’aumento della patologia alcolica e dismetabolica, rendendo pertanto il controllo eziologico della malattia stessa ancora più complesso, nell’attesa di disporre di terapie e strategie sempre più efficaci per contrastare l’abuso alcolico e la MASLD (11,12).
Circa il secondo aspetto, se in passato la terapia con NSBBs era limitata ai pazienti con varici esofagee a rischio di sanguinamento, negli anni più recenti il loro impiego (in particolare del carvedilolo) si è esteso a tutti i pazienti con CSPH, rappresentando un fattore in grado di influenzare il decorso clinico (13,14). Pur con i limiti sopra menzionati, possiamo concludere che questo studio rappresenta un ulteriore passo per migliorare la comprensione delle dinamiche della cirrosi scompensata e per la messa a punto di strategie sempre più efficaci nella sua prevenzione e gestione. Sarà cruciale lo sviluppo di test non invasivi, semplici ed economici in grado di identificare i pazienti maggiormente a rischio di evoluzione sfavorevole, sui quali concentrare i nostri sforzi, potendo ipotizzare per il prossimo futuro l’applicazione di terapie sempre più personalizzate.
- The Global Health Observatory. Global health estimates: Leading causes of death. WHO https://www.who.int/data/gho/data/themes/mortalityand-global-health-estimates/ghe-leading-causes-of-death. (2023).
- Moon AM, Singal AG, Tapper EB. Contemporary Epidemiology of Chronic Liver Disease and Cirrhosis. Clin Gastroenterol Hepatol. 2020;18:2650-2666.
- Asrani SK, Kouznetsova M, Ogola G, et al. Increasing Health Care Burden of Chronic Liver Disease Compared With Other Chronic Diseases, 2004–2013. Gastroenterology. 2018;155:719-729.
- Huang DQ, Terrault NA, Tacke F, et al. Global epidemiology of cirrhosis - aetiology, trends and predictions. Nat. Rev. Gastroenterol. Hepatol. 2023;20:388-398.
- Julien J, Ayer T, Bethea ED, et al. Projected prevalence and mortality associated with alcohol-related liver disease in the USA, 2019-40: a modelling study. Lancet Public Heal. 2020;5:e316-e323.
- Estes C, Anstee QM, Arias-Loste MT, et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016–2030. J. Hepatol. 2018;69:896-904.
- D’Amico G, Morabito A, D’Amico M, et al. New concepts on the clinical course and stratification of compensated and decompensated cirrhosis. Hepatol. Int. 2018;12:34-43.
- D’Amico G, Bernardi M, Angeli P. Towards a new definition of decompensated cirrhosis. J. Hepatol. 2022;76:202-207.
- Tonon M, D’Ambrosio R, Calvino V, et al. A new clinical and prognostic characterization of the patterns of decompensation of cirrhosis. J. Hepatol. 2023;1-7. 2023 Dec 17:S0168-8278(23)05359-X. Online ahead of print.
- Caraceni P, Abraldes JG, Ginès P,et al. The search for disease-modifying agents in decompensated cirrhosis: From drug repurposing to drug discovery. J. Hepatol. 2021;75:S118-S134.
- Idalsoaga F, Ayares G, Díaz LA, et al. Current and emerging therapies for alcohol-associated hepatitis. Liver Res. 2023;7:35-46.
- Dufour JF, Anstee QM, Bugianesi E, et al. Current therapies and new developments in NASH. Gut. 2022;71:2123–2134.
- Villanueva C, Albillos A, Genescà J, et al. β blockers to prevent decompensation of cirrhosis in patients with clinically significant portal hypertension (PREDESCI): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet 2019;393:1597-1608.
- de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII – Renewing consensus in portal hypertension. J. Hepatol. 2022;76:959-974







