La resezione epatica è il trattamento di scelta per numerosi tumori primitivi epatici e per le metastasi, in particolare colo-rettali e da tumori endocrini, con mortalità dell’1-3% nei centri di riferimento. La possibilità di resecare sino a tre quarti del fegato è basata sulla sua capacità rigenerativa, che è in grado di ricostituire rapidamente il volume originario.
La rigenerazione epatica prevede meccanismi che si attivano in modo sequenziale e parallelo, interagiscono tra di loro e si disinnescano quando la domanda metabolica è soddisfatta. Dopo epatectomia si osserva un aumento dei livelli sierici di TNF, di IL-6, HGF, serotonina e acidi biliari.
Questi eventi precoci (“priming”) portano a trascrizione genica e all’entrata di epatociti e colangiociti nel ciclo cellulare. I meccanismi di feed-back inibitorio e di controllo metabolico (via mTOR) regolano l’arresto del processo. La proliferazione progredisce dalle aree periportali verso il centrolobulo. Epatociti, colangiociti e, in alcuni tipi di danno, i progenitori epatici, replicano per primi, mentre le cellule immunitarie ed endoteliali vengono rimpiazzate più tardivamente per migrazione dal midollo osseo (1-4).
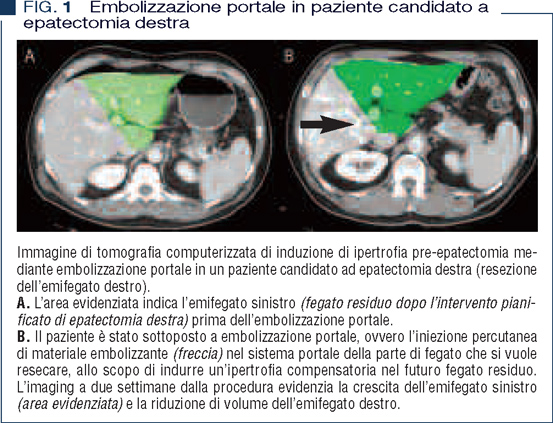 La capacità rigenerativa del fegato può essere alterata in caso di malattia epatica cronica, dopo chemioterapia e nell’anziano. Ci sono poi condizioni, quali la sepsi e lo shock ipovolemico (es. traumi epatici), in cui la capacità rigenerativa di un fegato peraltro sano può essere insufficiente. Il limite delle resezioni epatiche è duplice: anatomico (dato dalla necessità di preservare almeno due segmenti contigui con intatta vascolarizzazione e drenaggio biliare) e funzionale (dato dalla necessità di preservare parenchima sufficiente). L’insufficienza epatica post-epatectomia è definita come l’inabilità del fegato ad assolvere alle sue funzioni di sintesi, escretoria e di detossificazione, caratterizzata da iperbilirubinemia e INR allungato a partire dalla 5° giornata postoperatoria (5). E’ la più frequente causa di mortalità dopo epatectomia; la sua prevenzione è quindi fondamentale e si basa sulla pianificazione della resezione epatica con stima del volume del fegato residuo con imaging (tomografia computerizzata), su test statici (indici di funzionalità epatica, conta piastrinica, ecc.) o dinamici (clearance verde di indocianina) di funzionalità epatica, e su tecniche chirurgiche o radiologiche per aumentare la riserva funzionale del fegato residuo (come embolizzazione portale o epatectomia in due tempi) (Figura 1) (6).
La capacità rigenerativa del fegato può essere alterata in caso di malattia epatica cronica, dopo chemioterapia e nell’anziano. Ci sono poi condizioni, quali la sepsi e lo shock ipovolemico (es. traumi epatici), in cui la capacità rigenerativa di un fegato peraltro sano può essere insufficiente. Il limite delle resezioni epatiche è duplice: anatomico (dato dalla necessità di preservare almeno due segmenti contigui con intatta vascolarizzazione e drenaggio biliare) e funzionale (dato dalla necessità di preservare parenchima sufficiente). L’insufficienza epatica post-epatectomia è definita come l’inabilità del fegato ad assolvere alle sue funzioni di sintesi, escretoria e di detossificazione, caratterizzata da iperbilirubinemia e INR allungato a partire dalla 5° giornata postoperatoria (5). E’ la più frequente causa di mortalità dopo epatectomia; la sua prevenzione è quindi fondamentale e si basa sulla pianificazione della resezione epatica con stima del volume del fegato residuo con imaging (tomografia computerizzata), su test statici (indici di funzionalità epatica, conta piastrinica, ecc.) o dinamici (clearance verde di indocianina) di funzionalità epatica, e su tecniche chirurgiche o radiologiche per aumentare la riserva funzionale del fegato residuo (come embolizzazione portale o epatectomia in due tempi) (Figura 1) (6).
Il trattamento dell’insufficienza epatica post-operatoria si basa sul bilancio della volemia, la prevenzione di complicanze infettive, la reintroduzione precoce della nutrizione enterale, evitando farmaci epatotossici. In casi selezionati è indicato il trapianto di fegato. A livello sperimentale, sono stati studiati numerosi approcci promettenti (acidi biliari, cellule staminali e microvescicole da esse derivate, ecc.) che restano in attesa di validazione clinica (7, 8).
Bibliografia
- Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology. 2006; 43:S45-53.
- Michalopoulos GK. Liver regeneration after partial hepatectomy: critical analysis of mechanistic dilemmas. Am J Pathol. 2010; 176:2-13.
- Michalopoulos GK. Hepatostat: Liver regeneration and normal liver tissue maintenance. Hepatology. 2017; 65:1384-92.
- Lisman T, Porte RJ. Mechanisms of platelet-mediated liver regeneration. Blood. 2016; 128:625-9.
- Rahbari NN, Weitz J, Hohenberger W, et al. Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the International Study Group of Rectal Cancer. Surgery. 2010; 147:339-51.
- Edmondson MJ, Sodergren MH, Pucher PH, et al. Variations and adaptations of associated liver partition and portal vein ligation for staged hepatectomy (ALPPS): Many routes to the summit. Surgery. 2016; 159:1058-72.
- Alvarez-Sola G, Uriarte I, Latasa MU, et al. Bile acids, FGF15/19 and liver regeneration: From mechanisms to clinical applications. Biochim Biophys Acta. 2017.
- Herrera MB, Fonsato V, Bruno S, et al. Human liver stem cells improve liver injury in a model of fulminant liver failure. Hepatology. 2013; 57:311-9.







