Clostridiodes difficile è la principale causa di colite nosocomiale, e più in generale una delle principali cause di infezione nosocomiale, associata a significativi tassi di mortalità e di incremento della spesa sanitaria sia per le maggiori durate delle degenze ospedaliere sia per l’aumento delle vertenze medico-legali (1). L’infezione da C. difficile (CDI) è conseguenza della disbiosi intestinale secondaria a terapie antibiotiche e la sua incidenza nel singolo nosocomio rappresenta un marker del livello di adeguatezza del programma di antimicrobial stewardship (2). È importante quindi approcciare in maniera razionale e scientifica sia, in generale, la terapia antimicrobica alle sindromi infettive che, più specificamente, la CDI.
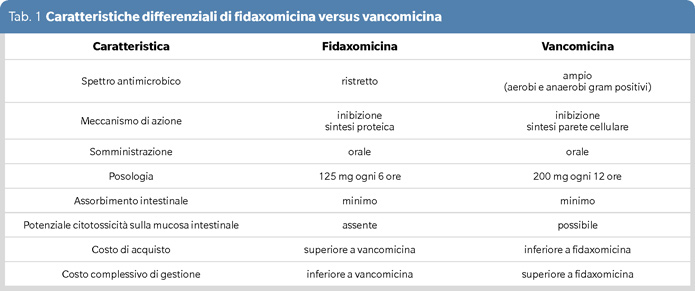
Recentemente vi è stato un accordo generale da parte delle principali società scientifiche internazionali sulle direttive della terapia del primo episodio di CDI e della prima eventuale ricorrenza con una sostanziale preferenza di fidaxomicina, capostipide della nuova classe degli antibiotici macrociclici, sulla vancomicina (3). La tabella 1 mostra le caratteristiche differenziali tra i due farmaci: lo spettro ristretto a C. difficile, il meccanismo di azione basato sulla inibizione della sintesi proteica (quindi in teoria anche delle sintesi e liberazione delle tossine) e la mancanza di un possibile effetto iatrogeno citolesivo diretto sulle mucose enteriche (possibile con vancomicina) (4) sembrano essere alla base della apparente superiorità di fidaxomicina nel prevenire le ricorrenze di CDI osservata nei trial registrativi (1,3,5). Perché allora si è inteso esprimersi nuovamente sulla gestione terapeutica della infezione da C. difficile con un consensus di esperti italiani appartenenti a varie discipline mediche (6 infettivologi, 2 gastroenterologi, 1 internista, 1 geriatra, 1 microbiologo, 1 farmacista ospedaliero ed 1 esperto di economia sanitaria e gestione delle risorse ospedaliere) (1)?
Di fatto, il consensus ha avuto lo scopo di pianificare una linea gestionale unica di diagnosi, terapia e profilassi della CDI cercando di integrare le attuali linee guida. Inoltre, un aspetto non secondario che si è voluto affrontare è stato anche risolvere o ridurre alcune difficoltà di applicazione delle linee guida per quanto riguarda l’impiego ottimale di fidaxomicina, a fronte di un farmaco, la vancomicina, comunque poco costoso e che rappresenta una buona alternativa nel trattamento della CDI.
Il ruolo di fidaxomicina
Nella vita reale non sono poche le farmacie ospedaliere che oppongono una significativa resistenza ad acquisire e dare disponibilità di fidaxomicina nelle condizioni sancite dalle linee guida. In tal senso, quindi, lo scopo del consensus è stato di distinguere i casi di CDI di significato clinico non grave, in cui la vancomicina è una più che valida opzione, dalle CDI gravi e/o associate ad elevato rischio di ricorrenza in cui non si può non considerare l’impiego di fidaxomicina. A tale scopo, gli studiosi si sono affidati alla metodologia Delphi per discutere alla luce delle evidenze scientifiche disponibili ed alla fine approvare, attraverso tre incontri, 23 dichiarazioni o statement. In estrema sintesi, dopo aver validato i criteri di diagnosi sanciti dalle linee guida, hanno diretto la loro attenzione per identificare le CDI a rischio di progredire verso una situazione clinica grave (e quindi a maggior rischio di morte) e/o predisposte alla ricorrenza: evenienze cioè per le quali di fatto andrebbe previsto l’impiego di fidaxomicina.
Gli autori hanno anche stabilito la definizione clinicamente più appropriata di malato fragile (quindi predisposto a più elevata mortalità in caso di CDI) attraverso l’adozione del Multidimensional Prognostic Index (6). Sono stati riconosciuti fattori di rischio per infezione grave l’età superiore a 65 anni, la ipoalbuminemia (<2.5 g/dl), la coesistenza di specifiche comorbidità (malattia infiammatoria intestinale, insufficienze renale o epatica, diabete, malattia polmonare o cardiaca e uno Zar score ≥2). Allo stesso modo, più fattori sono stati approvati come rappresentativi di CDI a rischio di recidiva: oltre l’età avanzata e la malattia infiammatoria intestinale e gli altri fattori associati a CDI grave, sono state riconosciute diverse cause di immunodepressione, la CDI nosocomiale o insorgente dopo recente ospedalizzazione, precedenti recidive ed esposizione ad antibiotici, quali fluorochinoloni, cefalosporine, carbapenemi e clindamicina. In tali evenienze gli autori hanno anche approvato l’impiego esteso di fidaxomicina (7): la dose totale del farmaco sarebbe la stessa rispetto a quella prevista con la classica somministrazione ogni 12 ore per 10 giorni complessivi. Tuttavia l’impiego esteso di fidaxomicina prevede che dopo i primi 5 giorni la somministrazione della compressa da 200 mg avvenga ogni 48 ore (7). Tra le altre opzioni per prevenire seconde/ulteriori recidive hanno ricevuto approvazione il trapianto di feci e l’impiego del monoclonale bezlotoxumab (quest’ultimo approvato anche come terapia del primo episodio di CDI, insieme a fidaxomicina o vancomicina, quando sono presenti almeno tre fattori di rischio per recidiva).
Ulteriore attenzione è stata rivolta agli ostacoli alla acquisizione da parte della farmacia ospedaliera della fidaxomicina. Come già menzionato il costo di fidaxomicina va considerato anche alla luce dei risparmi in termini di riduzione delle ricorrenze, più frequenti con vancomicina, che di fatto implicano degenze più protratte. Pertanto, una analisi di farmaco-economia andrebbe in qualche modo condotta in ogni singola istituzione rafforzando la comunicazione tra clinici e farmacisti ospedalieri, tenendo conto auspicabilmente degli statement in cui si è pronunciato il consensus.
CDI complicata da infezioni ematogene
Un aspetto che non è stato affrontato ha riguardato il fatto che la CDI può essere complicata oltre che dalle ricorrenze anche da candidemia e da batteriemie primitive (quindi presumibilmente a partenza dal tratto gastrointestinale leso dalla CDI in genere causate da enterobacteriales ed Enterococcus) concomitanti o successive alla manifestazione della sindrome enterocolitica (8).
Nei casi di CDI complicati da tali infezioni ematogene sono stati documentati persistenti aumenti nel siero degli indici di danno, translocazione e infiammazione enterica (9). Questi test potrebbero essere utili per individuare i soggetti a rischio. Allo stesso modo, è stato riportato che negli ospedali con endemia da enterobacteriales carbapenemi resistenti (CRE), tali microrganismi vengono isolati fino al 60% nei casi di batteriemie associate a CDI e rappresentano pertanto un elemento significativo di ulteriore aggravamento della prognosi (8,10). Una CDI grave, il fatto che l’infezione rappresenti una ricorrenza e il ceppo di C. difficile ipertossico sono fattori di rischio per batteriemia/candidemia associata (8): il loro riscontro dovrebbe autorizzare non solo l’impiego di fidaxomicina in terapia, ma anche di nistatina topica per prevenire quanto meno la candidemia (10). Va da sé che, negli ospedali ad alta endemia di CRE, anche la conoscenza dello stato di colonizzazione intestinale da questi microrganismi può essere utile per l’eventuale pianificazione della adeguata terapia empirica nei casi di CDI che sviluppano una sindrome compatibile con batteriemia primitiva.
CDI rimane un problema infettivo ricco di aspetti clinici, terapeutici e di prevenzione in continua evoluzione: la gestione ottimale prevede un preciso inquadramento clinico basato sulla conoscenza e la considerazione delle stimmate di infezione grave e dei fattori di rischio di ricorrenza. Da ultimo, gli andamenti di incidenza di CDI nosocomiale rispecchiano l’adeguatezza delle misure di infection control dopo ogni singolo caso di infezione e in generale di un uso virtuoso degli antibiotici: in tal senso rimane fondamentale l’adozione e la puntuale attuazione di programmi di antimicrobial stewardship negli ospedali.
- Bassetti M, Cascio A, De Rosa FG et al. Management of Clostridioides difficile infection: an Italian Delphi consensus. J Antimicrob Chemother. 2024 Jul13:dkae179. Online ahead of print.
- Granata G, Petrosillo N, Adamoli L, et al. Prospective study on incidence, risk factors and outcome of recurrent Clostridioides difficile infections. J Clin Med 2021;10:1127.
- Bishop EJ, Tiruvoipati R. Management of Clostridioides difficile infection in adults and challenges in clinical practice: review and comparison of current IDSA/SHEA, ESCMID and ASID guidelines. J Antimicrob Chemother 2022;78:21-30.
- Warren CA, van Opstal EJ, Riggins MS et al. Vancomycin treatment’s association with delayed intestinal tissue injury, clostridial overgrowth, and recurrence of Clostridium difficile infection in mice. Antimicrob Agents Chemother. 2013 ;57(2):689-96.
- Cornely OA, Crook DW, Esposito R et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis. 2012;12:281-9.
- Cella A, Veronese N, Custodero C et al. Validation of abbreviated form of the multidimensional prognostic index (MPI): the BRIEF-MPI project. Clin Interv Aging 2022;17:789-96.
- Guery B, Menichetti F, Anttila V-J et al. Extended-pulsed fidaxomicin versus vancomycin for Clostridium difficile infection in patients 60 years and older (EXTEND): a randomised, controlled, open-label, phase 3b/4 trial. Lancet Infect Dis. 2018; 18: 296–307.
- Falcone M, Russo A, Iraci F et al. Risk Factors and Outcomes for Bloodstream Infections Secondary to Clostridium difficile Infection. Antimicrob Agents Chemother. 2015;60(1):252-7.
- Oliva A, Aversano L, De Angelis M et al. Persistent Systemic Microbial Translocation, Inflammation, and Intestinal Damage During Clostridioides difficile Infection.Open Forum Infect Dis. 2019;7(1):ofz507.
- Falcone M, Venditti M, Sanguinetti M et al. Management of candidemia in patients with Clostridium difficile infection. Expert Rev Anti Infect Ther. 2016;14(7):679-85.







