Le vene che si trovano in territori in preda a infiammazione acuta di origine infettiva possono andare incontro a coinvolgimento nell’infezione con infiltrazione leucocitaria che può evolvere fino alla colliquazione purulenta e può approfondirsi dalla avventizia fino alla intima, sulla cui superficie endovasale non manca quasi mai la deposizione del trombo.
Il processo morboso, comunemente a impronta settica, è classicamente definito pertanto tromboflebite suppurativa (o settica); di conseguenza si può facilmente complicare con una estensione dell’infezione sia per via sistemica con disseminazione ematogena a partire dal versante trombotico, sia nei tessuti contigui lungo i vasi linfatici che decorrono nella avventizia vasale (1). Cadono sotto questa definizione la gran parte dei casi di tromboflebiti settiche secondarie a celluliti di cute e tessuti molli o, assai più raramente, a infezioni a carico della vena porta o delle mesenteriche, del distretto venoso contiguo a utero ed annessi, del seno cavernoso e della vena giugulare interna/succlavia nell’ambito della sindrome di Lemierre (1-3).
Nelle ultime decadi, tuttavia, la patologia infettiva del distretto venoso ha conosciuto una evoluzione in rapporto all’uso sempre più frequente dei cateteri endovascolari, soprattutto a carico dei vasi centrali del collo, e in generale dei malati critici in Terapia Intensiva. Sono in definitiva aumentate le possibilità di trombosi profonda sia in prossimità del trauma sul vaso venoso legato dalla inserzione di un catetere endovascolare, che del trauma legato ad un evento accidentale che, oltre che coinvolgere compartimenti muscolo-scheletrici, ne ha leso le relative strutture vascolari.
In queste circostanze la patologia infettiva si realizza essenzialmente sul trombo, contaminato spesso per via ematogena da focolai infettivi distanti o attraverso il sito di inserzione del catetere endovascolare, ma con minimo o assente coinvolgimento della avventizia (4). In questi casi il termine più appropriato dovrebbe essere trombosi settica per distinguere due eventi infettivi a carico del distretto venoso che dunque, come mostra la tabella 1, hanno eventi patogenetici distinti che possono sottendere presentazioni cliniche caratterizzate da elementi distintivi e che quindi, possibilmente, vanno affrontati con approccio clinico terapeutico diverso.
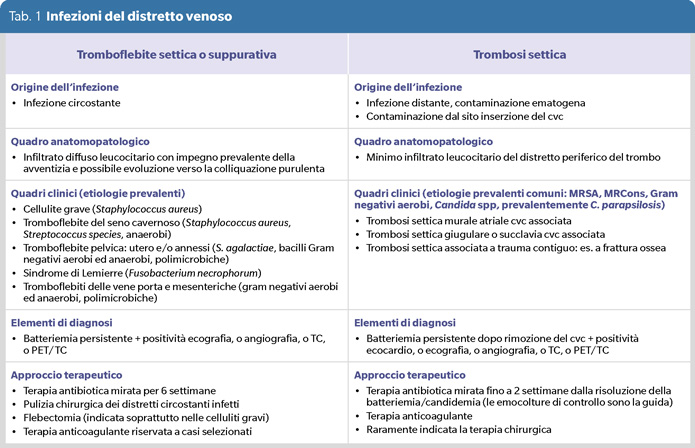
La gran parte delle tromboflebiti settiche originano su infezione di cute e tessuti molli e più frequentemente possono richiedere la pulizia chirurgica associata a flebectomia (1). Assolutamente rare sono le altre forme.
L’infezione del seno cavernoso che origina in genere dai seni paranasali si manifesta con chemosi, edema palpebrale e proptosi unilaterali ed ancora oggi è gravata di una mortalità pari al 30%, con frequenti sequele neurologiche nei casi di sopravvivenza: per questa infezione alcune autorità suggeriscono l’impiego combinato della terapia steroidea (5).
La tromboflebite pelvica è una complicanza post-partum o post-chirurgia ginecologica da sospettare in caso di febbre persistente in corso di terapia antibiotica appropriata, associato a dolore ed edema della radice della coscia. La terapia anticoagulante con eparina è consigliata fino alla risoluzione della febbre (2). Nella sindrome Lemierre, la tromboflebite della giugulare interna può complicare l’impegno dello spazio pterogoideo posteriore nell’ambito di infezioni del cavo orale a partenza odontogena o tonsillare: può complicarsi con eventi embolici settici polmonari (3).
Di crescente frequenza sono invece le trombosi settiche quasi sempre associate a catetere venoso centrale (cvc). Le principali etiologie sono classicamente Staphylococcus species meticillina resistenti acquisite in ospedale, quindi Staphylococcus aureus meticillina resistente (MRSA) e Staphylococcus species coagulasi negative (MRCons) (1,6), ma si sta oramai consolidando anche un ruolo importante anche per bacilli Gram negativi e Candida (4,7,8). Per le forme stafilococciche, ed in particolare da MRSA, rimosso il cvc, vi è evidenza da studi osservazionali che la terapia antibiotica mirata (vancocina o daptomicina per MRSA, oxacillina o cefazolina per i ceppi meticillina sensibili) vada protratta per almeno 4 settimane, a fronte di una documentata clearance della batteriemia, ed associata sempre a terapia anticoagulante (6). Nella quasi totalità dei casi non viene considerato l’intervento di flebectomia (6). Meno pronta può essere la risposta alla terapia antifungina (echinocandina o amfotericina B liposomale). La febbre e la fungemia possono persistere anche ben oltre la settimana dopo la rimozione del cvc, anche se il paziente mostra un miglioramento generale dello stato settico. Anche in questa circostanza è considerata utile la terapia anticoagulante, non la chirurgia (7).
Diversi aspetti di interesse caratterizzano le trombosi settiche da Gram negativi (4,8). Il primo di questi riguarda quando sospettare tali infezioni. Le batteriemie apparentemente primitive (verosimilmente a partenza dal tratto gastrointestinale) da questi microrganismi sono evenienza tutt’altro che infrequente nei pazienti in Terapia Intensiva. Tuttavia, quando febbre e batteriemia persistono a dispetto di una terapia antibiotica appropriata e della rimozione del cvc, la complicanza del trombo settico va sospettata soprattutto se la coltura della punta del cvc risulta positiva all’esame colturale quantitativo per lo stesso agente isolato dal sangue.
L’esame ecografico (ed ecocardiografico per escludere un impegno trombotico atriale) costituisce strumento imprescindibile di conferma della diagnosi (8). Alle volte il trombo infetto non è dei vasi centrali del collo (coltura cvc negativa e assenza di lesioni trombotiche agli esami ultrasonografici), e l’eventuale causa endovascolare della batteriemia persistente può essere in altri distretti che sono sede di varie forme di trauma sui vasi venosi (4).
Tipicamente nel paziente politrauma, alterazioni trombotiche contigue a focolai di frattura/ematoma muscolare, possono rappresentare il pabulum ideale di impianto in corso di batteriemia di germi a partenza da organi distanti (in genere il tratto gastrointestinale) (4,8). Va da sé quindi che in un contesto complesso come la Terapia Intensiva le emocolture di controllo vanno eseguite nel paziente critico con batteriemia da bacilli Gram negativi che persiste febbrile a scapito di terapia adeguata: rappresentano quindi un elemento imprescindibile per la diagnosi di trombosi settica (8,9).
Anche per queste infezioni la terapia antibiotica mirata ed anticoagulante sono le basi del trattamento: tuttavia elemento particolarmente critico riguarda la valutazione della risposta clinica anche ai fini della durata della somministrazione degli antibiotici.
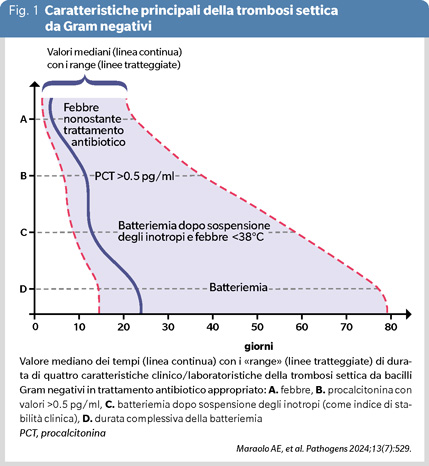 Di nuovo le emocolture di controllo hanno un ruolo fondamentale e permettono un corretto giudizio in tal senso (8). Infatti, come mostra la Figura 1 riassuntiva di una casistica di oltre 20 casi, nei pazienti che sopravvivono (e che rappresentano la quasi totalità) la necessità di farmaci inotropi, la scomparsa della febbre e la normalizzazione dei livelli di procalcitonina anticipano di molto la risoluzione della batteriemia, in alcuni casi addirittura di settimane (4,8). Evidentemente gli antibiotici riescono a ridurre l’intensità della batteriemia consentendo un apparente miglioramento clinico, ma la relativa esposizione dell’agente infettivo nella compagine del trombo rimane subottimale sin quando, con l’effetto sinergico della fibrinolisi, non si realizza l’eradicazione microbiologica. E ancora, l’esecuzione delle emocolture di controllo rappresenta la guida fondamentale per una corretta terapia (8). Nella già menzionata esperienza (4) gli antibiotici sono stati sospesi a 10-14 giorni dalla prima emocoltura negativa senza osservare recidive.
Di nuovo le emocolture di controllo hanno un ruolo fondamentale e permettono un corretto giudizio in tal senso (8). Infatti, come mostra la Figura 1 riassuntiva di una casistica di oltre 20 casi, nei pazienti che sopravvivono (e che rappresentano la quasi totalità) la necessità di farmaci inotropi, la scomparsa della febbre e la normalizzazione dei livelli di procalcitonina anticipano di molto la risoluzione della batteriemia, in alcuni casi addirittura di settimane (4,8). Evidentemente gli antibiotici riescono a ridurre l’intensità della batteriemia consentendo un apparente miglioramento clinico, ma la relativa esposizione dell’agente infettivo nella compagine del trombo rimane subottimale sin quando, con l’effetto sinergico della fibrinolisi, non si realizza l’eradicazione microbiologica. E ancora, l’esecuzione delle emocolture di controllo rappresenta la guida fondamentale per una corretta terapia (8). Nella già menzionata esperienza (4) gli antibiotici sono stati sospesi a 10-14 giorni dalla prima emocoltura negativa senza osservare recidive.
In conclusione, tromboflebite settica o suppurativa e trombosi settica sembrano rappresentare entità cliniche diverse con aspetti diagnostico terapeutici distinti. Riguardo la trombosi settica, entità clinica di riscontro sempre più frequente, sono necessari ulteriori studi e consensus di esperti per indirizzare in forma di linea guida sia l’approccio diagnostico che quello terapeutico.
- Fowler VJ, Sheld WM, Bayer AS. Endocarditis and intravascular infections. Bennett IE, Dolin R, Blaser MJ; Principles and practice of infectious diseases 8th Edition.Philadelphia: Elsevier; 2015. p. 1312–62
- Larsen JW, Hager DW, Livengood CH, et al Guidelines for the diagnosis, treatment and prevention of postoperative infections. Infect Dis Obstet Gynecol 2003;11:65-70
- Johannesen KM, Bodtger U. Lemierre’s syndrome: current perspectives on diagnosis and management. Infect Drug Resist. 2016;9:221-227
- Spaziante M, Giuliano S, Ceccarelli G, et al Gram-negative septic thrombosis in critically ill patients: A retrospective case-control study.Int J Infect Dis. 2020;94:110-115.
- Kraus CL, Culican SM: Challenging presentations of cavernous sinus thrombophlebitis. J Ophthalmic Inflamm Infect. 2012;2:133-6.
- Wilson RD, Chaftari AM, Hacchem RY, et al.Catheter-Related Staphylococcus aureus Bacteremia and Septic Thrombosis: The Role of Anticoagulation Therapy and Duration of Intravenous Antibiotic Therapy. Open Forum Infect Dis. 2018;5(10):ofy249.
- Caccese R, Carfagna P, Pistilli N, et al Candidal thrombophlebitis of central veins: case report and review..Med Mycol. 2012 Apr;50(3):299-304
- Maraolo AE, Ceccarelli G, Venditti M et al. Short Course Antibiotic Therapy for Catheter-Related Septic Thrombosis: "Caveat Emptor!": Duration of Therapy Should Not Be Set a Priori.Pathogens. 2024;13(7):529.
- Cogliati Dezza F, Curtolo A, Volpicelli L, et al. Are Follow-Up Blood Cultures Useful in the Antimicrobial Management of Gram-Negative Bacteremia? A Reappraisal of Their Role Based on Current Knowledge. Antibiotics (Basel). 2020;9(12):895.







