La storia naturale dell’infezione cronica da virus dell’epatite B (HBV) è suddivisa in 4 fasi: immunotolleranza (infezione cronica HBeAg-positiva), immunoattiva (epatite cronica HBeAg-positiva), portatore inattivo (infezione cronica HBeAg-negativa) e riattivazione immune (epatite cronica HBeAg-negativa) (1).
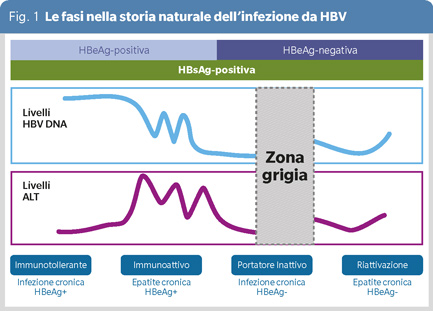 Nella fase di immunotolleranza, l’HBeAg è espresso nel sangue insieme all’HBV DNA ad alto titolo e le transaminasi (ALT) sono normali, il fegato non è malato; nella fase immunoattiva sono determinabili nel sangue l’antigene e (HBeAg) e l’HBV DNA, le ALT sono alterate, il fegato è malato. Queste due fasi terminano con la sieroconversione da HBeAg all’omologo anticorpo anti-HBe e con il controllo della replicazione virale. Nella fase del portatore inattivo, l’HBsAg rimane positivo ma il sistema immune controlla la viremia, le ALT sono normali ed il soggetto non presenta danno epatico; la prognosi è buona. Nella fase di riattivazione immune la viremia si riaccende, inducendo epatopatia cronica HBsAg ed anti-HBe positiva. Queste fasi virologiche sono consecutive nella storia naturale dell’infezione cronica da HBV ma appaiono spesso clinicamente isolate ed indipendenti l’una dall’altra (2).
Nella fase di immunotolleranza, l’HBeAg è espresso nel sangue insieme all’HBV DNA ad alto titolo e le transaminasi (ALT) sono normali, il fegato non è malato; nella fase immunoattiva sono determinabili nel sangue l’antigene e (HBeAg) e l’HBV DNA, le ALT sono alterate, il fegato è malato. Queste due fasi terminano con la sieroconversione da HBeAg all’omologo anticorpo anti-HBe e con il controllo della replicazione virale. Nella fase del portatore inattivo, l’HBsAg rimane positivo ma il sistema immune controlla la viremia, le ALT sono normali ed il soggetto non presenta danno epatico; la prognosi è buona. Nella fase di riattivazione immune la viremia si riaccende, inducendo epatopatia cronica HBsAg ed anti-HBe positiva. Queste fasi virologiche sono consecutive nella storia naturale dell’infezione cronica da HBV ma appaiono spesso clinicamente isolate ed indipendenti l’una dall’altra (2).
Sono disponibili due efficaci antivirali, entecavir e tenofovir, quest’ultimo col relativo profarmaco tenofovir alafenamide, che reprimono l’HBV DNA ematico e controllano l’epatopatia; tuttavia non riescono ad eliminare l’HBsAg e vanno somministrati indefinitamente. Le linee guida delle maggiori società epatologiche, incluse quelle dell’European Association for the Study of the Liver (EASL) (3), raccomandano di trattare con gli antivirali sia i pazienti che presentano cirrosi (indipendentemente dalle ALT e dalla viremia) che quelli che presentano malattia epatica non-cirrotica; non pongono invece indicazione alla terapia nella consistente proporzione dei portatori inattivi di HBsAg, raccomandando solo la sorveglianza periodica per confermare lo stato virologico-clinico di inattività.
 Nei pazienti non-cirrotici la distinzione fra chi trattare e non trattare poggia sui diversi valori di ALT e del titolo dell’HBV DNA nel siero (Figura 1). Non sono da trattare i portatori con ALT normali e HBV DNA assente o determinabile in quantità non superiore alle 2000 IU/ml, sono da trattare quelli con ALT alterate e HBV DNA determinabile a valori sopra 2000 IU/ml (3). Questa distinzione ha rappresentato il dogma clinico ma appare ora meno perentoria; s’è infatti riconosciuto che lo stato di immunotolleranza può non garantire da conseguenze patogene nel lungo termine (4), e che una proporzione di soggetti con infezione cronica da HBV non rientrano nelle categorie ufficiali, nel senso che presentano l’HBV DNA nei limiti ma le ALT alterate, oppure le ALT normali ma l’HBV DNA sopra la soglia di 2000 UI/ml; essi vengono ora classificati come portatori di HBsAg in fase indeterminata o zona grigia (grey zone) (Figura 1) (5), e da più Autori sono considerati a rischio di significativo danno epatico nel tempo (6). Sorge dunque il dilemma se tali soggetti vadano trattati solo se e quando svilupperanno complicazioni cliniche o se sia opportuno trattarli subito, senza evidenza di danno epatico, per prevenire eventuali complicazioni.
Nei pazienti non-cirrotici la distinzione fra chi trattare e non trattare poggia sui diversi valori di ALT e del titolo dell’HBV DNA nel siero (Figura 1). Non sono da trattare i portatori con ALT normali e HBV DNA assente o determinabile in quantità non superiore alle 2000 IU/ml, sono da trattare quelli con ALT alterate e HBV DNA determinabile a valori sopra 2000 IU/ml (3). Questa distinzione ha rappresentato il dogma clinico ma appare ora meno perentoria; s’è infatti riconosciuto che lo stato di immunotolleranza può non garantire da conseguenze patogene nel lungo termine (4), e che una proporzione di soggetti con infezione cronica da HBV non rientrano nelle categorie ufficiali, nel senso che presentano l’HBV DNA nei limiti ma le ALT alterate, oppure le ALT normali ma l’HBV DNA sopra la soglia di 2000 UI/ml; essi vengono ora classificati come portatori di HBsAg in fase indeterminata o zona grigia (grey zone) (Figura 1) (5), e da più Autori sono considerati a rischio di significativo danno epatico nel tempo (6). Sorge dunque il dilemma se tali soggetti vadano trattati solo se e quando svilupperanno complicazioni cliniche o se sia opportuno trattarli subito, senza evidenza di danno epatico, per prevenire eventuali complicazioni.
Portatori di HBsAg immunotolleranti
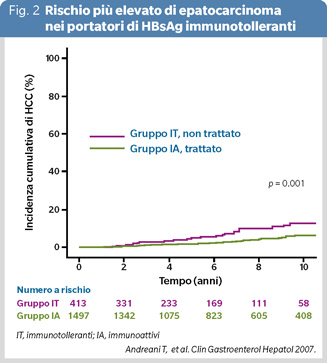
La principale ragione per trattare preventivamente gli immunotolleranti è che più studi hanno evidenziato come la viremia alta insieme all’HBsAg comportino negli anni a venire un consistente rischio di cirrosi, epatocarcinoma (HCC) e mortalità epatica. In una metanalisi di 9377 portatori di HBsAg raccolti in Cina da gennaio 1993 a novembre 2019, la prevalenza negli immunotolleranti di non-fibrosi, fibrosi significativa, fibrosi avanzata, è stata del 31,2%,16,9%, 5,4% rispettivamente (7). In 413 immunotolleranti coreani non trattati d’età media di 38 anni, seguiti per vari anni, l’incidenza di HCC è stata del doppio rispetto a quella di 1497 simili soggetti d’età media di 40 anni trattati con antivirali 30 (Figura 2) (8). Epatologi asiatici suggeriscono di iniziare subito una terapia a lungo termine; poiché quanto più avanza l’età dell’immunotollerante, tanto maggiore diventa il rischio di eventi patogeni; raccomandano comunque il trattamento con antivirali nei 35-40enni che rimangono immunotolleranti.
Altri studi non hanno invece rilevato negli immunotolleranti un rischio di epatopatia importante. In 40 immunotolleranti francesi d’età media di 29 anni, nessuno aveva fibrosi avanzata (9) ed in uno studio coreano il rischio di HCC era basso, pari ad una incidenza cumulativa dell’1,7% in 10 anni di follow-up (10).
 Una ragione per non trattare è che negli immunotolleranti la sieroconversione ad anti-HBe e l’eliminazione dell’HBsAg avvengono spesso spontaneamente; due studi, uno in 104 bambini d’età media di 7 anni (11) e l’altro in 240 adulti (12), hanno evidenziato sieroconversione nell’80% e nell’85% rispettivamente, dopo un follow-up di 23,7 e di 10,5 anni.
Una ragione per non trattare è che negli immunotolleranti la sieroconversione ad anti-HBe e l’eliminazione dell’HBsAg avvengono spesso spontaneamente; due studi, uno in 104 bambini d’età media di 7 anni (11) e l’altro in 240 adulti (12), hanno evidenziato sieroconversione nell’80% e nell’85% rispettivamente, dopo un follow-up di 23,7 e di 10,5 anni.
Una seconda ragione per limitare la terapia preventiva è che la sua efficacia nel contesto dell’immunotolleranza è scarsa. La seroconversione ad anti-HBe dopo tenofovir o tenofovir in associazione ad emtricitabina per 192 settimane ha avuto luogo solo in 3 di 126 pazienti (5%) in età media di 33 anni ed HBV DNA > 107 IU/mL; nessuno ha eliminato l’HBsAg (13). Jenq e Lok hanno rivisto gli studi pertinenti di terapia ed in 6 studi di immunotolleranti non selezionati trattati con antivirali hanno rilevato una percentuale cumulativa di sieroconversione ad anti-HBe di circa il 5% dopo 1-4 anni di terapia (4).
Appare dunque dalla letteratura che l’approccio nei confronti degli immunotolleranti è sostanzialmente diverso negli orientali rispetto ai caucasici. Ciò non sorprende in quanto le modalità d’infezione con l’HBV sono diverse, trasmessa nei primi prevalentemente per via perinatale da madre a neonato, nei secondi per via orizzontale attraverso contatti interpersonali (3).
Poiché il fattore principale che determina il decorso dell’infezione cronica da HBV è l’immunocompetenza al momento del contagio e quest’ultima è virtualmente nulla nel neonato, nei molti orientali infettati alla nascita il virus può rapidamente moltiplicarsi senza reazione clinica. Invece nei bambini/adolescenti caucasici infettati per via orizzontale attraverso contatti interumani diretti, il sistema immune è in sviluppo o già maturo e reagisce in modo parziale all’HBV, contenendo il virus a spese di un’infezione cronica subclinica o clinica.
Nel contesto epidemiologico italiano, il vaccino contro l’HBV obbligatorio da 33 anni ha eliminato gli immunotolleranti dalla popolazione HBsAg-positiva domestica. Rimangono pochi immunotolleranti tra gli immigrati HBsAg-positivi; l’approccio più congruo nei loro confronti pare il monitoraggio, con l’inizio della terapia antivirale solo se i pazienti transitano verso la fase immunoattiva e manifestano segni di danno epatico (14).
Portatori di HBsAg nella zona grigia
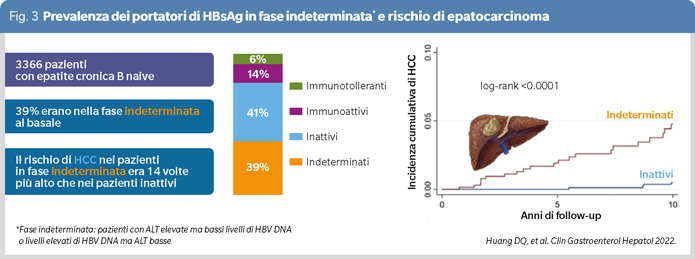
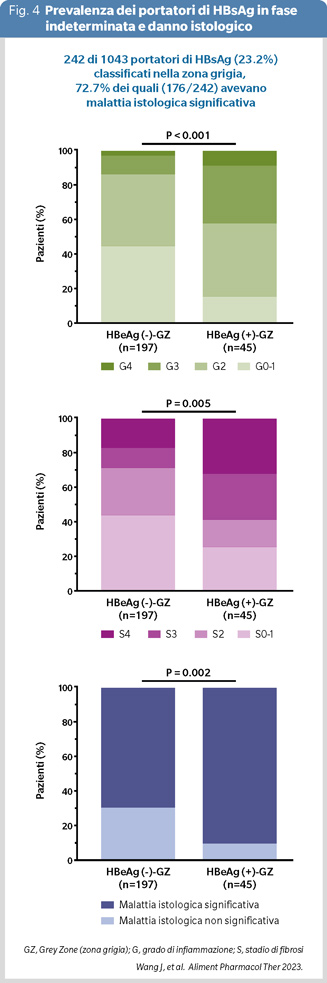
In studi orientali, la percentuale di portatori HBsAg in zona grigia indeterminata è rilevante, pari al 27,78% (1322 /4759) in cinesi nello studio di Yao e coll. (15) ed al 38,7% (1303/3366) in cinesi reclutati in America ed in Taiwan nello studio di Huang e coll. (Figura 3) (16); nel primo studio una quota consistente dei portatori nella zona grigia aveva fibrosi avanzata (33,3%) o cirrosi (25,8%), nel secondo l’incidenza di HCC in questi pazienti è stata superiore a quella dei portatori inattivi. Similmente lo studio di Wang e coll. ha mostrato che il 70-90% di 242 pazienti cinesi nellazona grigia aveva alterazioni istologiche epatiche importanti classificate come infiammazione di grado ≥G2 e/o fibrosi di stadio ≥S2 (Figura 4) (17), e lo studio di Choi e coll. in 5414 pazienti coreani HBeAg-negativi senza cirrosi ha rilevato un rischio di epatocarcinoma più alto nei 900 pazienti in zona grigia non trattati in confronto ai pazienti con infezione attiva trattati (18).
L’esperienza è stata tuttavia diversa in altri studi. In 153 portatori italiani HBeAg-negativi con HBV DNA al basale di ≤20.000-IU/mL e ALT normali (19), solo il 13,1% ha sviluppato un’epatite cronica B entro il primo anno di follow-up. Nell’ulteriore follow-up di 57,2 mesi in media, 133 sono rimasti stabili od hanno eliminato l’HBsAg o sono transitati verso un’infezione inattiva. In Spagna, 287 portatori di HBsAg con infezione HBV inattiva o nella zona grigia sono stati seguiti per una media di 8,2 (5-19 anni) (20). Il 15% dei pazienti in zona grigia ha perso l’HBsAg, il 40% è transitato in infezione inattiva. Solo il 6,3% ha sviluppato un’epatite cronica HBeAg-negativa: non v’è stato alcun caso di cirrosi o fibrosi avanzata.
La letteratura ripete nei pazienti in fase HBV indeterminata il diverso approccio a seconda della loro origine orientale o caucasica; nei primi la raccomandazione sembra essere la terapia antivirale preventiva (15-18), nei secondi, in particolare nei pazienti grigi, la cui prognosi appare eccellente, è raccomandato solo il monitoraggio nel tempo (19,20).
- McMahon BJ. The natural history of chronic hepatitis B virus infection. Hepatology. 2009;49(5 Suppl):S45-55.
- Kuo A, Gish R. Chronic hepatitis B infection. Clin Liver Dis. 2012;16:347-69.
- EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017;67:370-98.
- Jeng WJ, Lok AS. Should treatment indications for chronic hepatitis B be expanded? Clin Gastroenterol Hepatol 2021;19:2006-2014.
- Ridruejo E. Editorial: grey zone, a new area of interest in chronic hepatitis B. Aliment Pharmacol Ther. 2018;47:1547-1548.
- Liu YC, Jeng WJ. Editorial: considerations for expanding treatment in grey zone chronic hepatitis B patients. Aliment Pharmacol Ther. 2023;57:577-578.
- Lin MH, Li HQ, Zhu L, et al. Liver Fibrosis in the Natural Course of Chronic Hepatitis B Viral Infection: A Systematic Review with Meta-Analysis. Dig Dis Sci. 2022;67:2608-2626.
- Kim GA, Lim YS, Han S, et al. High risk of hepatocellular carcinoma and death in patients with immune-tolerant-phase chronic hepatitis B. Gut. 2018;67:945-952.
- Andreani T, Serfaty L, Mohand D, et al. Chronic hepatitis B virus carriers in the immunotolerant phase of infection: histologic findings and outcome. Clin Gastroenterol Hepatol 2007;5:636-641.
- Lee HA, Lee HW, Kim IH, et al. Extremely low risk of hepatocellular carcinoma development in patients with chronic hepatitis B in immune-tolerant phase. Aliment Pharmacol Ther. 2020;52:196-204.
- Wu JF, Su YR, Chen CH, et al. Predictive effect of serial serum alanine aminotransferase levels on spontaneous HBeAg sero- conversion in chronic genotype B and C HBV-infected children. J Pediatr Gastroenterol Nutr.2012;54:97-100.
- Chu CM, Hung SJ, Lin J, et al. Natural history of hepatitis B e antigen to antibody seroconversion in patients with normal serum aminotransferase levels. Am J Med 2004;116:829-834.
- Chan HL, Chan CK, Hui AJ, et al. Effects of tenofovir disoproxil fumarate in Hepatitis B e Antigen-positive patients with normal levels of alanine aminotransferase and high levels of Hepatitis B Virus DNA. Gastroenterology 2014;146:1240-1248.
- Chen CH. Should we expand treatment initiation for chronic hepatitis B infection? Cons. Clin Liver Dis (Hoboken). 2024;23:e0141.
- Yao K, Liu J, Wang Jet al. Distribution and clinical characteristics of patients with chronic hepatitis B virus infection in the grey zone. J Viral Hepat. 2021;28:1025-1033.
- Huang DQ, Li X, Le MH, et al. Natural History and Hepatocellular Carcinoma Risk in Untreated Chronic Hepatitis B Patients With Indeterminate Phase. Clin Gastroenterol Hepatol 2022;20:1803-1812.
- Wang J, Yan X, Zhu L, et al. Significant histological disease of patients with chronic hepatitis B virus infection in the grey zone. Aliment Pharmacol Ther 2023;57:464-474.
- Choi GH, Kim GA, Choi J, et al. High risk of clinical events in untreated HBeAg-negative chronic hepatitis B patients with high viral load and no significant ALT elevation. Aliment Pharmacol Ther. 2019;50:215-226.
- Oliveri F, Surace L, Cavallone D et al. Long-term outcome of inactive and active, low viraemic HBeAg-negative-hepatitis B virus infection: Benign course towards HBsAg clearance.Liver Int. 2017 +;37:1622-1631.
- Bonacci M, Lens S, Mariño Z et al. Anti-viral therapy can be delayed or avoided in a significant proportion of HBeAg-negative Caucasian patients in the Grey Zone. Aliment Pharmacol Ther 2018;47:1397-1408.







