Non è possibile risolvere l’infezione da Virus dell’Epatite D (HDV) con antivirali convenzionali perché il virus non è loro sensibile in quanto replicato direttamente dalle RNA polimerasi dall’epatocita infetto (1); per trent’anni l’unica terapia per l’epatite cronica D (ECD) è stato l’interferone alfa (2), trattamento di lunga durata, gravato da importante effetti collaterali e di limitata efficacia.
Poiché HDV necessita dell’HBsAg come capside per assemblarsi nella struttura infettiva, la nuova strategia terapeutica s’è rivolta ad inibire i processi che coinvolgono la sua interazione con HBsAg nel promuoverne l’entrata nell’epatocita e la formazione del virione (3). Sono stati sviluppati bulevirtide (BLV), lonafarnib e polimeri degli acidi nucleici (NAP), farmaci che a vario titolo inibiscono le funzioni collaterali dell’HBsAg necessarie al ciclo vitale dell’HDV; successivamente è stato introdotto l’interferone lambda cha ha attività antivirale prevalentemente intraepatica ed è meno tossico dell’interferone alfa che comporta effetti collaterali sistemici (4).
I progressi con bulevirtide
Nei mesi scorsi, tuttavia, lo sviluppo clinico di lonafarnib e peginterferone lambda è stato sospeso dai rispettivi produttori; seppur ricorrono comunicazioni di efficacia prolungata del NAP-REP 2139 in piccole casistiche, non v’è ancora studio che ne confermi una prospettiva di uso clinico esteso (5).
Rimane dunque in gioco solo BLV, approvato dall’European Medicines Agency (EMA) per uso commerciale nella terapia della ECD alla dose giornaliera di 2 mg sottocute (6). Il farmaco è un lipopeptide sintetico derivato dalla regione pre-S 1 dell’HBsAg grande (large): si lega in modo irreversibile al Sodium Taurocholate Cotransporting Polypeptide (NTCP), cioè al recettore per l’HBsAg dell’HDV e dell’HBV, inibendone l’entrata negli epatociti (7). Tuttavia l’uso e l’endpoint terapeutico appropriato di questo farmaco è controverso. L’European Association for the Study of the Liver (EASL) e l’American Association (for the Study of Liver Diseases (AASLD) hanno concordato due strategie, una che prevede l’eliminazione dell’HDV-RNA e la normalizzazione delle ALT sostenute nel tempo dopo la fine della terapia, l’altra di mantenimento che richiede la riduzione di >2 log10 dell’HDV-RNA dal suo titolo originale e la normalizzazione delle ALT (8); mentre la prima ha un endpoint accettato negli studi di coorti cliniche, la seconda è un surrogato empirico che manca ancora di un outcome clinico per valutarne il risultato finale.
Sebbene BLV rappresenti un cospicuo progresso nella terapia dell'ECD, la sua monoterapia presenta limitazioni; dopo 3 anni di terapia l’eliminazione dell’HDV-RNA ha avuto luogo nel 29% dei pazienti con la dose di 2 mg autorizzata dall’EMA, e nel 52% con la dose di 10 mg, ma già entro le prime 24 settimane dalla sospensione della terapia la viremia è recidivata nel 40-50% dei pazienti che avevano risposto (Figura 1). È dunque verosimile che la somministrazione del farmaco, adattata alla dose maggiore di 10 mg, debba continuare a lungo, se non indefinitamente; in assenza di un controllo, peraltro difficilmente realizzabile, si pone la problematica della valutazione della sua efficienza e tolleranza nel lungo termine.
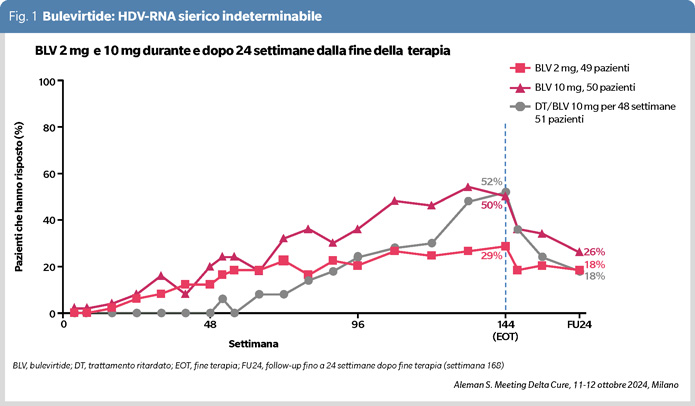
Non meraviglia dunque che siano in atto tentativi di ritornare al classico endpoint dell’eliminazione dell’HDV, che comporterebbe la fine della terapia. Due le nuove proposte nella ECD HDV-RNA positiva, una di combinare in una terapia di tempo finito l’interferone alfa peghilato (PegIFNα) con BLV, l’altra di cercare di ridurre l’HBsAg o perlomeno di manipolarlo in modo tale da renderlo incapace a provvedere le funzioni necessarie al ciclo vitale dell’HDV.
Sono stati pubblicati i risultati della combinazione di 2 mg o di 10 mg di BLV sottocute una volta al giorno con PegIFN alla dose di 180 microgrammi settimanali nelle ECD compensate, con o senza cirrosi (9). Cinquanta pazienti sono stati trattati con BLV 2 mg/PegIFN per 48 settimane, seguite da terapia con solo BLV 2 mg per altre 48 settimane; 50 pazienti con BLV 10 mg/PegIFN per 48 settimane, seguite da terapia con solo BLV 10 mg per altre 48 settimane; 24 pazienti solo con PegIFN per 24 settimane; 50 pazienti solo con BLV 10 mg per 96 settimane. Tutti i gruppi sono stati seguiti fino alla 144a settimana dall’inizio della terapia. Endpoint primario dello studio è stata la negatività del test per HDV-RNA 24 settimane dopo la fine della terapia, quello secondario la negatività del test 48 settimane dopo la fine della terapia.
La dinamica dell’HDV-RNA nel corso della terapia è evidenziata nella figura 2.
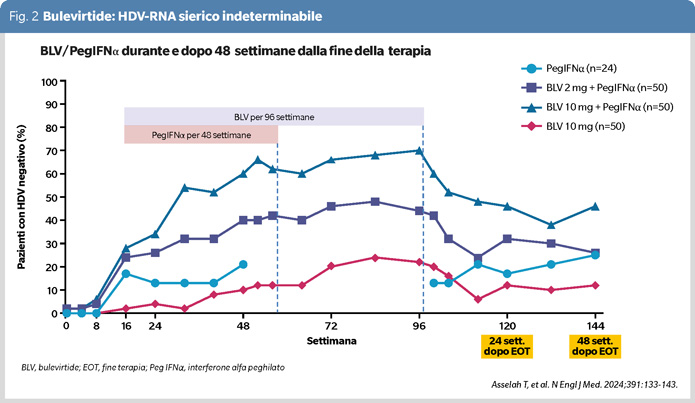
La percentuale di negatività della viremia durante la terapia è stata più alta nel gruppo BLV 10 mg/PegIFN arrivando a 70% alla fine della terapia (EOT) per poi scendere al 46% alla 24a dalla fine della terapia e stabilizzarsi a questo livello alla 48a settimana; la percentuale di risposta più bassa è stata nel gruppo trattato con 10 mg di BLV, solo il 12% alla fine dello studio. Interessante notare che, mentre nelle modalità di terapia combinata la risposta è diminuita dopo la fine della terapia, essa è invece marginalmente aumentata con PegIFN in monoterapia, malgrado l’interruzione del farmaco alla 48a settimana e la mancata registrazione della sua attività farmacologica tra la 48a e 96a settimana. Le transaminasi sono migliorate consensualmente con il controllo della viremia. La fibrosi epatica, misurata come rigidità dell’organo (Fibroscan), è diminuita fino a -4 kPa dall’originale nei gruppi in terapia combinata per poi risalire fino a circa -2.5 kPa dall’originale alla fine della terapia. Minima l’eliminazione dell’HBsAg; cinque, due ed uno dei pazienti trattati rispettivamente con BLV 2 mg/PegIFN, BLV 10 mg/PegIFN e BLV 10 mg da solo, avevano eliminato l’antigene dal sangue alla 48a settimana dopo la terapia.
Seppur è evidente il beneficio nel raggiungere la negatività dell’HDV-RNA (10), rimane incerto se la clearance virale con BLV 10 mg/PegIFN sia definitiva, in quanto la combinazione non è comunque riuscita a prevenire la recidiva dell’infezione; come evidenziato nella figura 2, il calo percentuale della risposta dopo la fine della terapia è stato infatti simile agli altri protocolli di trattamento, cioè del 66% nel gruppo BLV 10 mg/PegIFN, del 59% nel gruppo BLV 2 mg/PegIFN, del 55% nel gruppo BLV 10 mg in monoterapia; questo rende plausibile sulla base della precedente esperienza con PegIFN monoterapia (11), che anche il nuovo protocollo ottimale non sia scevro di ulteriori recidive fuori-terapia nel tempo a venire.
Naturalmente PegIFN per un anno è male accetto per le reazioni collaterali che induce; dunque se la terapia finita di combinazione si confermasse valida, la scelta per il paziente sarebbe un anno di disagio con il PegIFN o una puntura sottocute giornaliera con BLV per un tempo indefinito.
Lo Studio SOLSTICE
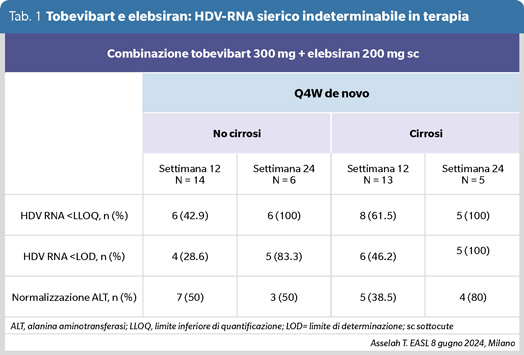 Sono stati presentati all’ultimo EASL i risultati preliminari dello studio SOLSTICE sull’efficacia nella ECD HDV-RNA positiva della combinazione di tobevibart (VIR 3434) e di elebsiran (VIR 2218) (12). Tobevibart inibisce l’entrata del virus B e D nell’epatocita e induce l’eliminazione dei virioni HDV liberi per opsonizzazione; elebsiran riduce l’espressione dell’RNA dell’HBV. Il protocollo prevede una iniezione sottocute della combinazione ogni 4 settimane per 96 settimane in 32 pazienti, di cui 18 cirrotici. I risultati in 27 pazienti che hanno raggiunto le 12 e 24 settimane di terapia sono riportati in tabella 1.
Sono stati presentati all’ultimo EASL i risultati preliminari dello studio SOLSTICE sull’efficacia nella ECD HDV-RNA positiva della combinazione di tobevibart (VIR 3434) e di elebsiran (VIR 2218) (12). Tobevibart inibisce l’entrata del virus B e D nell’epatocita e induce l’eliminazione dei virioni HDV liberi per opsonizzazione; elebsiran riduce l’espressione dell’RNA dell’HBV. Il protocollo prevede una iniezione sottocute della combinazione ogni 4 settimane per 96 settimane in 32 pazienti, di cui 18 cirrotici. I risultati in 27 pazienti che hanno raggiunto le 12 e 24 settimane di terapia sono riportati in tabella 1.
L’HBsAg è calato in media di 3.3 log10 dopo 24 settimane di terapia. A 24 settimane i 5 pazienti cirrotici sono scesi sia sotto la soglia di quantificazione dell’HDV-RNA che sotto la soglia della sua determinazione, sono scesi sotto la soglia di quantificazione i 6 pazienti non cirrotici e 5 di loro sotto la soglia di determinazione; la percentuale globale di eliminazione dell’HDV-RNA rasenta dunque il 100%. La percentuale di normalizzazione delle ALT è stata del 50% nei pazienti non cirrotici e dell’80% nei pazienti cirrotici. La maggioranza delle reazioni collaterali sono state modeste, di 1° e 2° grado; non si sono verificate riaccensioni delle ALT.
L’eradicazione dell’HBsAg o la sua manipolazione in modo da renderlo incapace di combinarsi con la ribonucleoproteina virale costituiscono la più diretta e razionale strategia per eliminare l’HDV; i risultati preliminari dello studio SOLSTICE sono promettenti nel perseguire questa nuova terapia.
- Taylor JM. Infection by hepatitis delta virus. Viruses 2020;12:648.
- Rizzetto M, Smedile A. PEG-IFN for the treatment hepatitis D: in need of revision. Hepatology 2015;61:1109-11.
- Usai C, Gill US, Riddell AC, et al. Emerging insights into the immunopathology, clinical and therapeutic aspects of hepatitis delta virus. Aliment Pharmacol Ther 2022;55:978-93.
- Etzion O, Hamid S, Lurie Y, et al. Treatment of chronic hepatitis D with peginterferon lambda — the phase 2 LIMT-1 clinical trial. Hepatology 2023; 77:2093-103.
- Bazinet M, Pântea V, Cebotarescu V, et al. Persistent Control of Hepatitis B Virus and Hepatitis Delta Virus Infection Following REP 2139-Ca and Pegylated Interferon Therapy in Chronic Hepatitis B Virus/Hepatitis Delta Virus Coinfection. Hepatol Commun. 2020;5:189-202.
- European Medicines Agency. Hepcludex (bulevirtide). Product information. 2023 (https://www.ema.europa.eu/en/ medicines/human/EPAR/hepcludex).
- Bogomolov P, Alexandrov A, Voronkova N, et al. Treatment of chronic hepatitis D with the entry inhibitor Myrcludex B: First results of a phase Ib/IIa study. J Hepatol 2016;65:490-8.
- Yurdaydin C, Abbas Z, Buti M, et al. Treating chronic hepatitis delta: the need for surrogate markers of treatment efficacy. J Hepatol 2019;70:1008-15.
- Asselah T, Chulanov V, Lampertico P, et al. Bulevirtide combined with Pegylated Interferon for Chronic Hepatitis D. N Engl J Med. 2024;391:133-143.
- Lok AS,Negro F, Asselah T, et al. Endpoints and new options for treatment of chronic hepatitis D. Hepatology 2021;74:3479-85.
- Wedemeyer H, Yurdaydin C, Dalekos GN, et al. Peginterferon plus adefovir versus either drug alone for hepatitis delta. N Engl J Med 2011;364:322-31.
- Asselah T. Efficacy and safety of tobevibart (VIR-3434) alone or in combination with elebsiran (VIR-2218) in participants with chronic hepatitis delta virus infection: preliminary results from the phase 2 SOLSTICE trial in non-cirrhotic and compensated cirrhotic participants European Association for the Study of the Liver Congress; 8 June 2024; Milan, Italy. OS-127.







