Gli enterococchi rappresentano un genere di batteri di crescente importanza clinica, noti per la loro capacità di causare infezioni comunitarie e nosocomiali e per la loro intrinseca tolleranza/resistenza ai farmaci antinfettivi. La storia di Enterococcus è lunga e complessa e risale a più di un secolo fa.
Il termine enterocoque fu utilizzato per la prima volta da Thiercelin nel 1899 (1), segnando l’inizio del riconoscimento di questi batteri come entità distinta. Nel 1906, fu coniato il nome Streptococcus faecalis e questo rappresentava un iniziale tentativo di classificazione degli enterococchi all’interno del genere Streptococcus. Nel 1937, fu proposto uno schema tassonomico che distingueva gli enterococchi dagli streptococchi non-enterococcici (1). Si dovrà attendere il 1984 per il trasferimento di Streptococcus faecalis e Streptococcus faecium all’interno del genere Enterococcus, distinto dal genere Streptococcus (1).
Il 1947 rappresentò una pietra miliare nella storia delle Malattie Infettive: in quell’anno Hunter dimostrò che la combinazione di penicillina e streptomicina produceva un effetto sinergico e battericida in vitro nei confronti degli enterococchi penicillina-sensibili non altamente resistenti agli aminoglicosidi (non-HLAR), suggerendo la possibilità di impiegare questa combinazione nel trattamento dell’endocardite enterococcica (2).
Approcci “tradizionali”
Dopo la scoperta del sinergismo tra beta-lattamico e aminoglicoside (2), la terapia di combinazione di penicillina o ampicillina (MIC enterococco da due a quattro volte inferiori rispetto a quelle della penicillina G) con aminoglicoside divenne il trattamento convenzionale dell’endocardite infettiva (EI) da Enterococcus penicillina-sensibile non-HLRA. Negli anni successivi, si esplorarono nuove combinazioni di farmaci antinfettivi. Nel 2007, uno studio multicentrico spagnolo valutò l’efficacia di ampicillina più ceftriaxone in 43 pazienti affetti da EI da E. faecalis, mostrando un tasso di cura clinica del 67.4% a 3 mesi; nei pazienti con HLAR-E. faecalis, il tasso di cura fu del 100%; non vi furono episodi di batteriemia breakthrough, ma si verificarono 2 casi di recidiva nel gruppo non-HLAR; la combinazione si dimostrò efficace e sicura, potendo rappresentare un’alternativa per pazienti a rischio di nefrotossicità (3).
Nel 2013 uno studio multicentrico, osservazionale, non randomizzato valutò l’efficacia delle combinazioni di ampicillina più ceftriaxone (AC) e ampicillina più gentamicina (AG) nel trattamento dell’EI da E. faecalis: non si rilevarono differenze significative tra i gruppi AC e AG in termini di mortalità durante il trattamento o a 3 mesi, fallimento del trattamento o recidive, tuttavia, l’interruzione del trattamento antibiotico per eventi avversi fu molto più frequente nei pazienti trattati con AG, principalmente per lo sviluppo di danno renale acuto; AC si è dimostrò efficace quanto AG, indipendentemente dallo stato di resistenza agli aminoglicosidi di E. faecalis (4).
La combinazione di ampicillina e ceftriaxone è il trattamento di scelta dell’EI di valvola nativa (NVE) e protesica (PVE) causate da HLAR E. faecalis e ha lo stesso livello di raccomandazione di AG nel trattamento di NVE e PVE dovute a non-HLAR E. faecalis (5).
Nuovi approcci terapeutici
Ampicillina e ceftobiprolo
Il razionale microbiologico alla base dell’efficacia di AC è la saturazione parziale delle PBPs essenziali di E. faecalis, PBP4 e PBP5: questo determina l’iperespressione delle PBPs non essenziali, PBP2 e PBP3, alle quali si lega il ceftriaxone, raggiungendo così una condizione di saturazione totale delle PBPs enterococciche (6,7). A differenza delle cefalosporine di terza generazione, ceftobiprolo mostra la capacità di legarsi con alta affinità a PBP2, PBP3, PBP4 e PBP5 di enterococco (8,9). Questo suggerisce un possibile ruolo nel trattamento dell’EI. Per tale motivo abbiamo utilizzato la combinazione di ampicillina e ceftobiprolo in 21 pazienti ricoverati nel nostro ospedale da gennaio 2020 a dicembre 2020 per la terapia di infezioni gravi da E. faecalis (61% endocardite infettiva e 39% batteriemia complicata) (10).
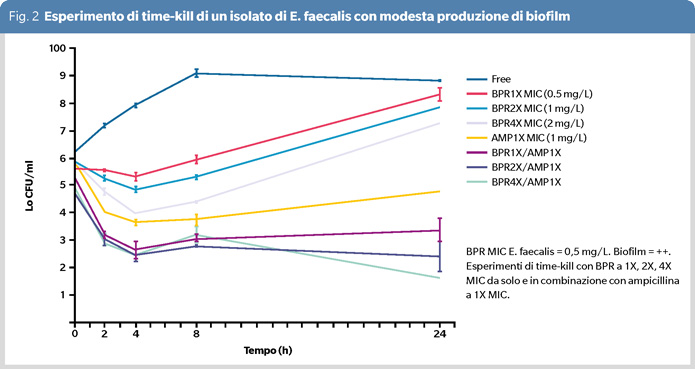
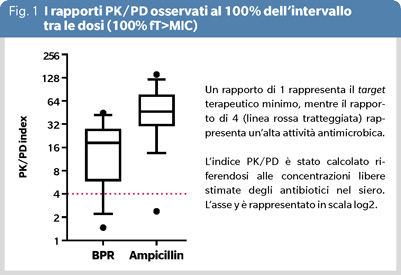 Abbiamo osservato un alto tasso di successo clinico (81%) e un elevato tasso di eradicazione microbiologica (86%) (10). Nella maggior parte dei pazienti, le concentrazioni plasmatiche allo stato stazionario di ampicillina e ceftobiprolo rimanevano costantemente elevate durante la terapia e i rapporti tra le concentrazioni plasmatiche degli antibiotici di tutti i pazienti e le MICs degli isolati di E. faecalis superavano il target PK/PD di elevata efficacia (>4) antinfettiva (Figura 1). Negli esperimenti di time-kill condotti su alcuni degli isolati clinici di E. faecalis, ceftobiprolo mostrava un’attività battericida così potente a una concentrazione quattro volte superiore alla MIC che un effetto sinergico con l’ampicillina non era nemmeno dimostrabile. In figura 2, è illustrato l’esperimento di time-kill di un isolato di E. faecalis con moderata produzione di biofilm e una MIC di ceftobiprolo di 0.5 mg/L. Il ceftobiprolo da solo non mostrava, in questo caso, un effetto battericida a concentrazioni pari a 1, 2 e 4 volte la MIC, nemmeno dopo 24 ore di incubazione. Inoltre, l’isolato si caratterizzava per una ricrescita dopo otto ore di esposizione al farmaco. Il test con striscia a gradiente di antibiotico (E-test) condotto su questo ceppo mostrava una MIC di 0.75 mg/L e si osservavano colonie con eteroresistenza all’interno della zona di inibizione con MIC di 16 mg/L. Tuttavia, quando questo isolato veniva esposto a concentrazioni di ceftobiprolo pari a 1X MIC, 2X MIC e 4X MIC insieme all’ampicillina a una concentrazione pari alla MIC, si dimostrava un effetto sinergico a 8 e 24 ore dall’esposizione ai farmaci. Abbiamo ipotizzato che tre meccanismi specifici siano alla base della perdita di attività battericida del ceftobiprolo: resistenza ed eteroresistenza, capacità di formare biofilm e quorum sensing.
Abbiamo osservato un alto tasso di successo clinico (81%) e un elevato tasso di eradicazione microbiologica (86%) (10). Nella maggior parte dei pazienti, le concentrazioni plasmatiche allo stato stazionario di ampicillina e ceftobiprolo rimanevano costantemente elevate durante la terapia e i rapporti tra le concentrazioni plasmatiche degli antibiotici di tutti i pazienti e le MICs degli isolati di E. faecalis superavano il target PK/PD di elevata efficacia (>4) antinfettiva (Figura 1). Negli esperimenti di time-kill condotti su alcuni degli isolati clinici di E. faecalis, ceftobiprolo mostrava un’attività battericida così potente a una concentrazione quattro volte superiore alla MIC che un effetto sinergico con l’ampicillina non era nemmeno dimostrabile. In figura 2, è illustrato l’esperimento di time-kill di un isolato di E. faecalis con moderata produzione di biofilm e una MIC di ceftobiprolo di 0.5 mg/L. Il ceftobiprolo da solo non mostrava, in questo caso, un effetto battericida a concentrazioni pari a 1, 2 e 4 volte la MIC, nemmeno dopo 24 ore di incubazione. Inoltre, l’isolato si caratterizzava per una ricrescita dopo otto ore di esposizione al farmaco. Il test con striscia a gradiente di antibiotico (E-test) condotto su questo ceppo mostrava una MIC di 0.75 mg/L e si osservavano colonie con eteroresistenza all’interno della zona di inibizione con MIC di 16 mg/L. Tuttavia, quando questo isolato veniva esposto a concentrazioni di ceftobiprolo pari a 1X MIC, 2X MIC e 4X MIC insieme all’ampicillina a una concentrazione pari alla MIC, si dimostrava un effetto sinergico a 8 e 24 ore dall’esposizione ai farmaci. Abbiamo ipotizzato che tre meccanismi specifici siano alla base della perdita di attività battericida del ceftobiprolo: resistenza ed eteroresistenza, capacità di formare biofilm e quorum sensing.
La non suscettibilità al ceftobiprolo in E. faecalis deriva principalmente dalla sovraespressione di PBP4, indotta da mutazioni nella regione promotrice, e da alterazioni nei motivi del sito catalitico di PBP4 che potrebbero interferire con la formazione del complesso ceftobiprolo/PBP4 (9). La non suscettibilità antimicrobica è legata a un costo in termini di fitness (trade-off): in presenza di antibiotici, i ceppi resistenti prevalgono sui batteri suscettibili, mentre in ambienti privi di antibiotici, sono svantaggiati rispetto ai ceppi suscettibili; l’eteroresistenza, caratterizzata da un costo in termini di fitness inferiore rispetto alla resistenza completa, è un fenotipo più favorevole in condizioni di pressione antibiotica.
Nel biofilm i batteri agiscono collettivamente e si comportano come un organismo multicellulare per rispondere a varie condizioni ambientali e questo fenomeno è noto come sistema di quorum sensing (11). I fenotipi di resistenza ed eteroresistenza sono regolati dal quorum sensing attraverso la produzione di autoinduttori. Nel contesto del biofilm, sotto la pressione antibiotica, le sottopopolazioni di batteri resistenti ed eteroresistenti acquisiscono un vantaggio selettivo rispetto alle popolazioni suscettibili agli antibiotici e la triade rappresentata da biofilm, quorum sensing e sviluppo della resistenza e, in particolare, dell’eteroresistenza, grazie al suo vantaggio rispetto alla resistenza completa, potrebbe spiegare il comportamento dell’isolato di E. faecalis al quale si riferisce la curva di time-kill della figura 2. Si potrebbe ipotizzare che la combinazione di ampicillina e ceftobiprolo, legandosi alle PBPs enterococciche a un livello critico necessario per inibire il sistema di quorum sensing, potrebbe invertire l’eteroresistenza, distruggere il biofilm e portare a un effetto sinergico battericida nei confronti di E. faecalis. Le nostre osservazioni evidenziano il potenziale ruolo del ceftobiprolo da solo o in combinazione con ampicillina come una promettente opzione terapeutica per l’EI da E. faecalis.
Dalbavancina e oritavancina
Dalbavancina è un derivato lipoglicopeptidico semisintetico long-acting della teicoplanina, attivo contro batteri gram-positivi inclusi Streptococcus spp., E. faecalis vancomicina-sensibile, Enterococcus faecium vancomicina sensibile, Staphylococcus aureus sensibile alla meticillina (MSSA), S. aureus resistente alla meticillina (MRSA) e stafilococchi coagulasi-negativi (12).
Oritavancina è un lipoglicopeptide long-acting con attività anche nei confronti dei E. faecalis vancomicina-resistente ed E. faecium vancomicina-resistente (13). Entrambi i farmaci potrebbero rappresentare una valida opzione nella terapia sequenziale dell’EI enterococcica.
- Murray BE. The life and times of the Enterococcus. Clin Microbiol Rev 1990;3:46-65.
- Hunter TH. Use of streptomycin in the treatment of bacterial endocarditis. Am J Med 1947;2:436-442.
- Gavaldà J, Len O, Miró JM, et al. Brief communication: treatment of Enterococcus faecalis endocarditis with ampicillin plus ceftriaxone. Ann Intern Med 2007;146:574-9.
- Fernández-Hidalgo N, Almirante B, Gavaldà J, et al. Ampicillin plus ceftriaxone is as effective as ampicillin plus gentamicin for treating enterococcus faecalis infective endocarditis. Clin Infect Dis 2013;56:1261-8.
- Delgado V, Ajmone Marsan N, de Waha S, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J 2023;44:3948-4042.
- Mainardi JL, Gutmann L, Acar JF, Goldstein FW. Synergistic effect of amoxicillin and cefotaxime against Enterococcus faecalis. Antimicrob Agents Chemother 1995;39:1984-1987.
- Gavalda J. Efficacy of ampicillin combined with ceftriaxone and gentamicin in the treatment of experimental endocarditis due to Enterococcus faecalis with no high-level resistance to aminoglycosides. Journal of Antimicrobial Chemotherapy 2003;52:514-517.
- Henry X, Amoroso A, Coyette J, Joris B. Interaction of ceftobiprole with the low-affinity PBP 5 of Enterococcus faecium. Antimicrob Agents Chemother 2010;54:953-5.
- Lazzaro LM, Cassisi M, Stefani S, Campanile F. Impact of PBP4 Alterations on β-Lactam Resistance and Ceftobiprole Non-Susceptibility Among Enterococcus faecalis Clinical Isolates. Front Cell Infect Microbiol 2022;11:816657.
- Giuliano S, Angelini J, D’Elia D, et al. Ampicillin and Ceftobiprole Combination for theTreatment of Enterococcus faecalis Invasive Infections: ’The Times They Are A-Changin’. Antibiotics (Basel) 2023 May 9;12(5):879.
- Vendeville A, Winzer K, Heurlier K, Tang CM, Hardie KR. Making ’sense’ of metabolism: autoinducer-2, LUXS and pathogenic bacteria. Nat Rev Microbiol 2005;3:383-396.
- Leighton A, Gottlieb AB, Dorr MB, et al. Tolerability, Pharmacokinetics, and Serum Bactericidal Activity of Intravenous Dalbavancin in Healthy Volunteers. Antimicrob Agents Chemother 2004;48:940-945.
- Saravolatz LD, Stein GE. Oritavancin: A Long-Half-Life Lipoglycopeptide. Clinical Infectious Diseases 2015;61:627-632.







