Il tratto gastrointestinale è un importante sito patogenetico dell’infezione da HIV, in quanto ospita la maggior parte dei linfociti T CD4+ dell’organismo. Al di là della deplezione delle cellule T CD4+ a livello mucosale, HIV è in grado di determinare un danno diretto delle cellule epiteliali con ridotta espressione delle proteine delle giunzioni strette. Il danno intestinale viene ulteriormente amplificato da altri fenomeni, in particolare:
- la perdita di sottopopolazioni mucosali CD4+ Th17 e Th22, fisiologicamente coinvolte nel mantenimento
- dell'omeostasi della barriera intestinale, tramite l'espressione delle proteine delle giunzioni strette, la regolazione
- del ciclo cellulare e la stimolazione della secrezione di peptidi antimicrobici e muco (1);
- l’alterazione della composizione del microbiota intestinale, portando a disbiosi con ridotta diversità batterica, impoverimento di microbi protettivi e arricchimento di batteri patogeni pro-infiammatori (2);
- l’instaurarsi di infiammazione e di fibrosi intestinale (2).
Nel loro complesso, tali fenomeni portano ad un’alterazione funzionale della mucosa con aumentata permeabilità intestinale e successivo passaggio di microbi/frammenti microbici dal lume intestinale alla circolazione periferica (2). La traslocazione microbica rappresenta un’importante concausa di attivazione e infiammazione periferiche caratterizzanti l’infezione da HIV (2). In maniera interessante, il lipopolisaccaride circolante (LPS), componente della barriera dei batteri Gram negativi e quindi marcatore surrogato di traslocazione microbica, è stato associato a progressione clinica in corso di storia naturale di malattia (3); anche il CD14 solubile (sCD14), marcatore di attivazione monocitaria in seguito al riconoscimento di LPS, è stato associato ad eventi clinici sia in persone che vivono con HIV (PVH) naive allaterapia antiretrovirale di combinazione (cART), sia in individui viro-soppressi (4,5). In linea con tali dati, nelle PVH riceventi una cART viro-soppressiva, marcatori solubili di infiammazione/coagulazione (IL-6, sTNFR-I, sTNFR-II, sCD14, il rapporto KT plasmatico, D-dimero), di danno intestinale (I-FABP, zonulina-1) e di iperattivazione immunitaria innata sono stati associati ad un rischio maggiore di morbilità e mortalità non correlate all'AIDS (6,7). In aggiunta, anche la sopracitata disbiosi intestinale, è stata associata non solo a marcatori infiammatori, ma anche allo sviluppo di comorbosità non infettive in PVH in stabile trattamento antivirale (8).
Da tali osservazioni emerge un concetto di estrema rilevanza, ovvero che danno intestinale, traslocazione microbica e attivazione immunitaria/infiammazione persistono in corso di cART efficace e potrebbero contribuire alla genesi delle comorbosità non infettive in PVH.
Per tale motivo, diversi gruppi di ricerca hanno intrapreso lo studio della barriera intestinale su tessuto bioptico con l’obiettivo di comprovare il danno mucosale in corso di cART viro-soppressiva in PVH ed hanno effettivamente dimostrato elevati livelli di infiltrazione neutrofila/apoptosi mucosale (9), ridotta espressione delle proteine giunzionali del colon (10), aumentata permeabilità intestinale ed alterazioni del microbioma (11).
Sulla base di questi risultati, appare assodato che la terapia cART, introdotta in fase cronica di infezione da HIV, non sia in grado di ristabilire la fisiologica omeostasi intestinale. Ad oggi, tuttavia, non è noto se la cART intrapresa in fasi più precoci di malattia possa contenere il danno intestinale HIV-relato e la cascata patogenetica che ne consegue. Per tale motivo, il nostro gruppo di ricerca ha voluto indagare l’entità del danno della barriera mucosale in PVH in infezione acuta per meglio comprendere il possibile spazio della cART precoce in tale contesto.
Nell’ambito del progetto INACTION, il nostro gruppo ha di recente pubblicato un lavoro dal titolo Primary HIV infection features colonic damage and neutrophil inflammation yet containment of microbial translocation (12).
Presso la Clinica di Malattie Infettive e Tropicali dell’Ospedale San Paolo, Dipartimento di Scienze della Salute, Università degli Studi di Milano, abbiamo arruolato 15 individui con infezione primaria (P-HIV) (classificati in base a un’antigenemia p24 positiva o a un HIV RNA rilevabile con un test di conferma del Western Blot negativo o indeterminato) e 13 individui con infezione cronica (C-HIV). Campioni biologici di sangue periferico e le biopsie intestinali ottenute durante colonscopia, sono stati ottenuti previo consenso informato, approvato dal Comitato Etico dell'ASST Santi Paolo e Carlo, Milano. Tutti gli individui erano naive alla terapia antiretrovirale. Nei soggetti arruolati abbiamo studiato: la struttura della barriera intestinale (proteine delle giunzioni strette quali Zonula Occludens-1 ed E-caderina con colorazione immunoistochimica), l’immunità mucosale (frequenza delle cellule T γδ e Vδ1/Vδ2 mediante citofluorimetria), i livelli di HIV DNA nel colon (HIV DNA totale, non integrato e integrato con qPCR), fibrosi ed infiammazione (infiltrazione dei neutrofili mediante mieloperossidasi e deposizione di collagene mediante colorazione Masson) ed infine marcatori plasmatici di traslocazione microbica e danno intestinale (LPS, sCD14, EndoCAb e I-FABP mediante ELISA). Non sono state osservate differenze tra i gruppi in termini demografi ci, tuttavia i P-HIV presentavano un nadir di cellule T CD4 significativamente più alto (474 cell/ml [330–576] vs 237 cell/ml [50–422], p=0.0074) e una tendenza ad una conta di cellule T CD4 più alta al momento dell'analisi (518 cell/ml [359–662] vs 378 cell/ml [176–508], p= 0.060), nonché una minore prevalenza di eventi che definiscono l'AIDS nella loro storia clinica rispetto ai C-HIV (1 [7] vs 6 [46], p=0.029). Il reservoir virale è risultato significativamente più e levato nei P-HIV rispetto ai C-HIV in termini sia di DNA totale (6290 copies/106 cells [18138.3–11480] vs 455 copies/106 cells [35–1614], p =0.02), sia di DNA non integrato (189 copies/106 cells (70.70–556.5) vs 45 copies/106 cells [7–84], p=0.01), ed integrato (6069 copies/106 cells [731.5–10862] v s 413 copies/106 cells [28–1477], p=0.02). Inoltre i livelli di HIV DNA sono risultati più alti nelle prime fasi dell'infezione primaria (Fiebig II-III), diminuendo gradualmente nelle fasi successive (Fiebig IV,V) e stabilizzandosi ai livelli osservati nell'infezione cronica.
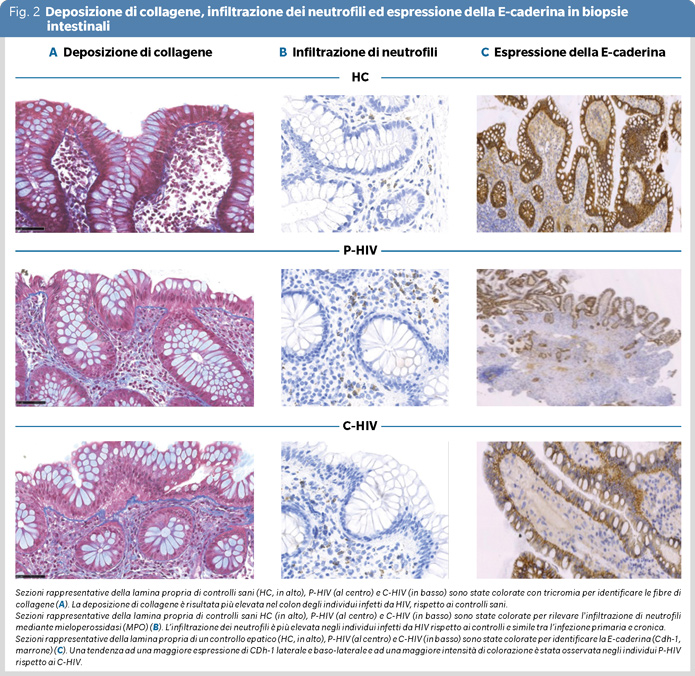
Abbiamo invece osservato simile grado di fibrosi, deplezione delle cellule T CD4+ e l'infiltrazione neutrofila nel colon, tra gli individui con infezione primaria e cronica da HIV (Figura 1 e 2 A, B). Al contrario, l'espressione della E-caderina (CDh-1), proteina coinvolta nell'integrità della barriera intestinale, è risultata più elevata nei P-HIV rispetto ai C-HIV, (Figura 1 e 2 C).
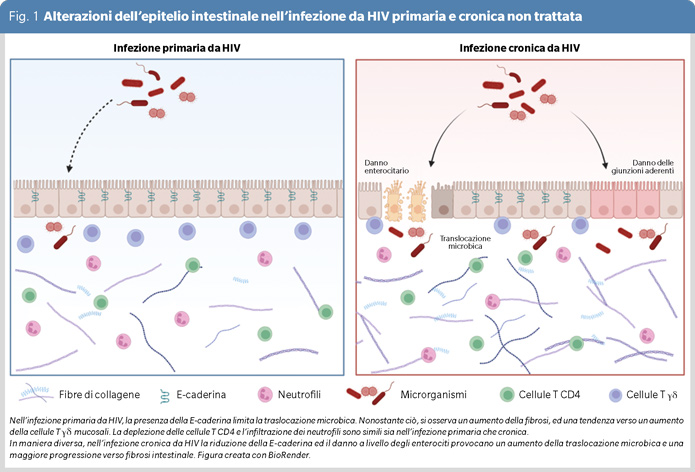
In linea con quest’ultimo dato, la traslocazione microbica è risultata più contenuta durante l'infezione acuta da HIV, in quanto i livelli di LPS (188.8 pg/ml [145.1–234.2] vs 345.8 pg/ml [216.4–368.3] p=0.006), sCD14 (1.58 mg/ml [1.05–2.208] vs 5.953 mg/ml [3.95–11.17], p=0.0002) e I-FABP (186.9 pg/ml [127.7–406] vs 1210 pg/ml [367.4–1644], p=0.03) sono risultati significativamente più bassi nei P-HIV rispetto ai C-HIV. Vistala correlazione negativa fra cellule T γδ e marcatori di danno intestinale (deposizione di collagene, r=-0.67, p=0.06) e di traslocazione microbica (sCD14, r=-0.62, p=0.09), i nostri dati suggeriscono un ruolo di tali cellule nel mantenimento dell’integrità intestinale e del contenimento della traslocazione microbica.
Nel loro insieme, i risultati dello studio dimostrano che danno intestinale e reservoir tissutali si instaurano a partire dalle prime fasi dell’infezione acuta da HIV; tuttavia, essi non si traducono in un aumentato grado di permeabilità intestinale, come evidente da ridotti livelli di traslocazione microbica. Tali dati pongono le basi per future ricerche volte a valutare se l’inizio tempestivo della cART nelle primissime fasi di infezione possa effettivamente ripristinare la struttura e la funzione della barriera mucosale, portando a minor traslocazione microbica/infiammazione periferica e, quindi, a un migliore outcome clinico per le persone che vivono con HIV.
- Mudd JC, Brenchley JM. Gut Mucosal Barrier Dysfunction, Microbial Dysbiosis, and Their Role in HIV-1 Disease Progression. J Infect Dis 2016; 214 Suppl 2(Suppl 2):S58-66.
- Brenchley JM, Price DA, Schacker TW, et al. Microbial translocation is a cause of systemic immune activation in chronic HIV infection. Nature Medicine 2006; 12(12):1365-1371.
- Marchetti G, Cozzi-Lepri A, Merlini E, et al. Microbial translocation predicts disease progression of HIV-infected antiretroviral-naive patients with high CD4+ cell count. AIDS 2011; 25(11):1385-1394.
- Sandler NG, Wand H, Roque A, et al. Plasma levels of soluble CD14 independently predict mortality in HIV infection. J Infect Dis 2011; 203(6):780-790.
- Justice AC, Freiberg MS, Tracy R, et al. Does an index composed of clinical data reflect effects of inflammation, coagulation, and monocyte activation on mortality among those aging with HIV? Clin Infect Dis 2012; 54(7):984-994.
- Tenorio AR, Zheng Y, Bosch RJ, et al. Soluble markers of inflammation and coagulation but not T-cell activation predict non-AIDS-defining morbid events during suppressive antiretroviral treatment. J Infect Dis 2014; 210(8):1248-1259.
- Hunt PW, Sinclair E, Rodriguez B, et al. Gut epithelial barrier dysfunction and innate immune activation predict mortality in treated HIV infection. J Infect Dis 2014; 210(8):1228-1238.
- Vujkovic-Cvijin I, Sortino O, Verheij E, et al. HIV-associated gut dysbiosis is independent of sexual practice and correlates with noncommunicable diseases. Nat Commun 2020; 11(1):2448.
- Somsouk M, Estes JD, Deleage C, et al. Gut epithelial barrier and systemic inflammation during chronic HIV infection. AIDS 2015; 29(1):43-51.
- Tincati C, Douek DC, Marchetti G. Gut barrier structure, mucosal immunity and intestinal microbiota in the pathogenesis and treatment of HIV infection. AIDS Res Ther 2016; 13:19.
- Ancona G ME, Tincati C, Barassi A, et al. Long-Term Suppressive cART Is Not Sufficient to Restore Intestinal Permeability and Gut Microbiota Compositional Changes. Front Immunol. 202;12:639291.
- Tincati C, Bono V, Cannizzo ES, et al. Primary HIV infection features colonic damage and neutrophil inflammation yet containment of microbial translocation. AIDS 2024; 38(5):623-632.







