La presenza della resistenza trasmessa ai farmaci antiretrovirali (TDR) può compromettere in modo significativo l’efficacia della terapia antiretrovirale combinata (ART) di prima linea, se i pazienti sono trattati con un regime non completamente attivo, ed è associata ad un maggior rischio di progressione della malattia (1, 2).
La prevalenza di farmaco-resistenze per le tradizionali classi di antivirali (inibitori della proteasi e inibitori della trascrittasi inversa) in pazienti naive alla ART oscilla tra il 6% ed il 15% nei paesi europei e in Nord America (3, 4).
In Africa meridionale e orientale, la TDR presenta una prevalenza maggiore ed in crescita, in particolare nei confronti degli inibitori non nucleosidici della trascrittasi inversa, che rappresentano la pietra miliare dei regimi antiretrovirali di prima linea raccomandati in questi paesi (5).
Negli ultimi anni in Italia è stata riportata una prevalenza della TDR pari al 10% circa, stabile nella coorte ICONA nel periodo 2007-2014 (6), mentre è in significativo calo nella coorte ARCA, dal 14% nel 2006 a circa il 7% nel 2016 (7), a conferma di un trend precedentemente riportato fino al 2010 (8) (Figura 1).
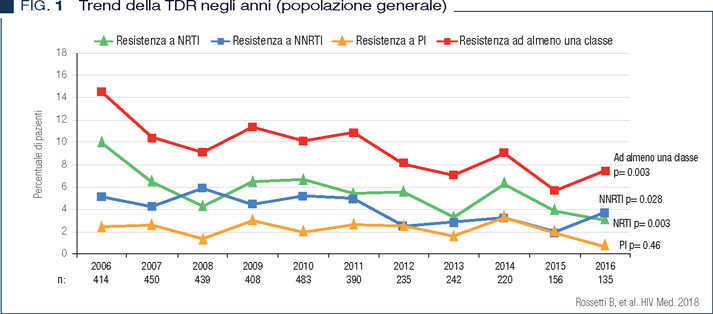
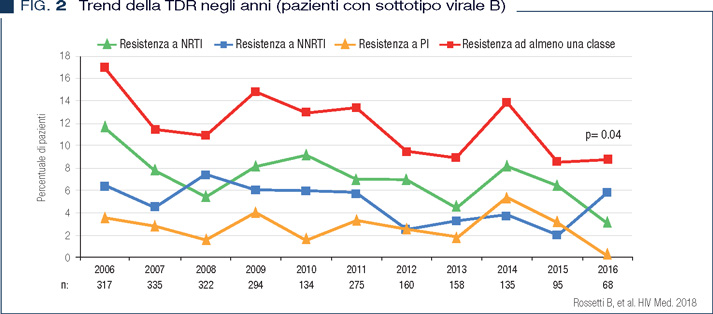
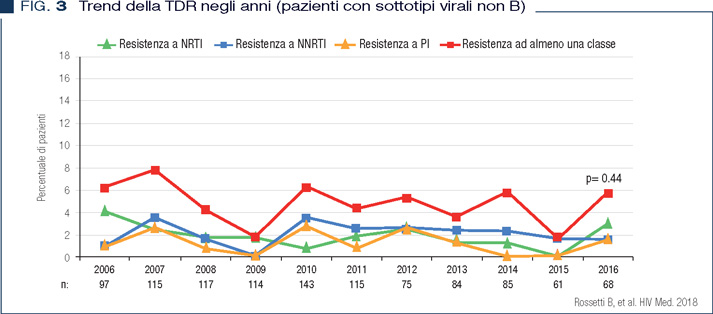
La prevalenza di TDR a NNRTI sembra essere in incremento negli ultimi anni di osservazione in entrambe le coorti. Sebbene complessivamente il sottotipo virale B sia tuttora prevalente, si sta assistendo ad un progressivo e significativo incremento dei sottotipi virali non-B che sono ormai endemici anche nella popolazione italiana (7-9). Tra i sottotipi virali non B il CRF02_AG appare in maggiore incremento ed è il più rappresentato tra i pazienti provenienti dall’Africa sub-sahariana. Nella coorte ARCA la prevalenza di TDR è risultata complessivamente più frequente nei portatori del sottotipo virale B rispetto ai portatori dei sottotipi non B, con un trend significativamente in calo negli ultimi anni proprio nel clade B ed una prevalenza stazionaria nei sottotipi non B (Figure 2 e 3).
Il riscontro in Italia come in Europa di resistenze trasmesse agli INSTI rimane aneddotico con recenti casi sporadici, che, in assenza di altre mutazioni, potrebbero per alcuni rappresentare rari polimorfismi naturali piuttosto che resistenza emersa in pazienti trattati e poi effettivamente trasmessa. L’uso della classe è divenuto negli anni sempre più importante ed è pertanto indispensabile una continua sorveglianza delle resistenze primarie agli INSTI nei prossimi anni (10).
Una maggiore prevalenza di TDR agli NNRTI è stata riscontrata nei pazienti originari dell’Africa sub-sahariana e dell’Europa orientale, mentre quella per gli NRTI è risultata più frequente in pazienti nati in Italia e in quelli originari dell’America Latina e dei Caraibi, riflettendo l’epidemiologia della resistenza pre-trattamento nelle diverse regioni di provenienza (5). In questa casistica la prevalenza di qualsiasi TDR è risultata leggermente ma non significativamente più elevata tra i consumatori di droghe iniettabili rispetto agli altri fattori di rischio, ciò a differenza di altre segnalazioni di TDR superiore tra pazienti con fattore di rischio omo-bisessuale (11), una differenza che potrebbe essere spiegata dalla trasmissione dell’HIV in cluster da pazienti fonte trattati durante gli anni passati con farmaci antiretrovirali meno efficaci.
La prevalenza della TDR in un’area geografica è un processo dinamico in continua evoluzione in relazione all’impiego dei farmaci antiretrovirali, ai flussi migratori ed ai diversi comportamenti ed il test di resistenza genotipica rimane quindi ampiamente raccomandato prima di iniziare il trattamento antiretrovirale di prima linea. La conoscenza dei sottotipi di HIV attualmente circolanti, della loro associazione con la resistenza ai farmaci e della dinamica della loro diffusione è fondamentale per ottimizzare i regimi antiretrovirali nella lotta globale contro l’HIV/AIDS..
Bibliografia
- Guidelines on the public health response to pretreatment HIV drug resistance. Supplement to the 2016 consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: second edition June 2016. Geneva: World Health Organization; 2017.
- Linee guida Italiane sull’utilizzo dei farmaci antiretrovirali e sulla gestione diagnostico-clinica delle persone con infezione da HIV-1. http://http://www.salute.gov.it/imgs/C_17_pubblicazioni_2696_allegato.pdf
- Zazzi M, Hu H, Prosperi M. The global burden of HIV-1 drug resistance in the past 20 years. Peer J. 2018 May 25; 6:e4848.
- Wheeler WH, Ziebell RA, Zabina H, et al. Prevalence of transmitted drug resistance associated mutations and HIV-1 subtypes in new HIV-1 diagnoses, U.S.-2006. AIDS. 2010; 24:1203-12.
- Gupta RK, Gregson J, Parkin N, et al. HIV-1 drug resistance before initiation or re-initiation of first-line antiretroviral therapy in low-income and middle-income countries: a systematic review and meta-regression analysis. Lancet Infect Dis. 2017 Dec 5. pii: S1473-3099(17)30702-8.
- Franzetti M, De Luca A, Ceccherini-Silberstein F, et al. Evolution of HIV-1 transmitted drug resistance in Italy in the 2007-2014 period: a weighted analysis. J Clin Virol. 2018; 106:49-52.
- Rossetti B, Di Giambenedetto S, Torti C, et al. Evolution of transmitted HIV-1 drug resistance and viral subtypes circulation in Italy from 2006 to 2016. HIV Med. 2018 Jun 22.
- Colafigli M, Torti C, Trecarichi EM, et al. Evolution of transmitted HIV-1 drug resistance in HIV-1-infected patients in Italy from 2000 to 2010. Clin Microbiol Infect. 2012; 18:E299-304.
- Fabeni L, Alteri C, Di Carlo D, et al. Dynamics and phylogenetic relationships of HIV-1 transmitted drug resistance according to subtype in Italy over the years 2000-14. J Antimicrob Chemother. 2017; 72(10):2837-2845.
- Casadellà M, van Ham PM, Noguera-Julian M, et al. Primary resistance to integrase strand-transfer inhibitors in Europe. J Antimicrob Chemother. 2015; 70(10):2885-8.
- Hauser A, Hofmann A, Hanke K, et al. National molecular surveillance of recently acquired HIV infections in Germany, 2013 to 2014. Euro Surveill. 2017; 22:pii:30436.







