La terapia antiretrovirale (ART) rappresenta uno dei più grandi successi terapeutici nell’ambito delle infezioni virali. Grazie alla ART le persone che vivono con HIV (PLWH) hanno una aspettativa di vita praticamente paragonabile a quella di individui negativi per questo virus; essa ha inoltre consentito di applicare il principio noto come U=U (undetectable=untransmittable) che ha rivoluzionato un importante aspetto sociale collegato a questa infezione (1).
È noto a tutti tuttavia che, nonostante questo considerevole successo, ad oggi non esiste una cura in grado di eradicare l’infezione da HIV.
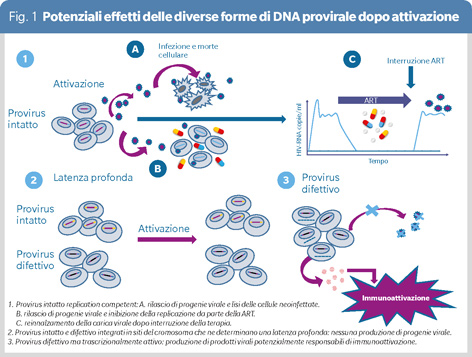 Infatti nel corso della storia naturale dell’infezione, già nelle primissime fasi, la replicazione di HIV induce la formazione dei cosiddetti serbatoi virali (reservoir), ad oggi inattaccabili dai regimi terapeutici in uso. Il reservoir di HIV, responsabile del rebound della carica virale a seguito di interruzione della terapia, è comunemente definito come una popolazione di cellule che alberga DNA provirale (provirus), replication competent, capace cioè di portare alla produzione di nuova progenie virale (2,3).
Infatti nel corso della storia naturale dell’infezione, già nelle primissime fasi, la replicazione di HIV induce la formazione dei cosiddetti serbatoi virali (reservoir), ad oggi inattaccabili dai regimi terapeutici in uso. Il reservoir di HIV, responsabile del rebound della carica virale a seguito di interruzione della terapia, è comunemente definito come una popolazione di cellule che alberga DNA provirale (provirus), replication competent, capace cioè di portare alla produzione di nuova progenie virale (2,3).
Il provirus persistente può essere però presente in 3 diverse forme (Figura 1):
- provirus intatto che può essere latente o produttivo a seconda dello stato di attivazione o meno della cellula;
- provirus difettivo, ossia un DNA virale che presenta delezioni o ipermutazioni e, per questo, incapace di dar luogo a progenie virale ed al conseguente reinnalzamento della carica virale;
- provirus intatto ma che, a causa dello specifico sito di integrazione, si trova in uno stato di latenza profonda che ne influenza l’attivazione (4).
Relativamente al tipo di cellule responsabili del fenomeno sopradescritto, deve essere menzionato il fatto che, sebbene le cellule T CD4+ della memoria siano da sempre considerate il principale sito di persistenza virale, anche altre cellule, come i macrofagi e le cellule dendritiche, sembrano avere un ruolo importante nella persistenza virale (3).
Nell’ultimo decennio, le numerose ricerche eseguite per cercare di comprendere meglio la natura dei reservoir virali hanno portato a nuove ed importanti acquisizioni. È emerso un quadro molto più dinamico e complesso di quanto si credeva.
Complessità della natura del reservoir
Storicamente il principale serbatoio cellulare è stato sempre associato alle cellule resting T CD4+ caratterizzate da una lunga emivita; studi recenti hanno dimostrato che nelle PLWH in trattamento, il DNA provirale si ritrova frequentemente in cellule T CD4+ che mostrano una breve emivita come le transitional e le effector memory. Inoltre, molti soggetti in terapia ART, esprimono il marker di attivazione HLA-DR che poco si associa ad uno stato di quiescenza. Queste osservazioni suggeriscono che il serbatoio di HIV continui a proliferare durante la terapia e che la longevità della cellula interessata non è il solo fattore responsabile della persistenza. L’ipotesi più accreditata al momento è che la massiva espansione clonale delle cellule che albergano provirus intatti e/o difettivi sia responsabile del mantenimento delle cellule infette durante la terapia ART (5).
 Ad oggi esistono diverse tecniche che permettono non solo di valutare in maniera quantitativa la persistenza virale, ma anche la capacità del provirus di essere trascritto e/o tradotto. Ognuna di queste metodiche presenta dei vantaggi e dei limiti (Tabella 1). Attualmente il quantitative Viral Outgrowth Assay, noto come qVOA, e il più recente Intact Proviral DNA Assay (IPDA) rappresentano i metodi più utilizzati per studiare la persistenza di HIV (6,7). Il primo saggio permette di misurare il provirus capace di replicare, mentre l’altro ha il grande vantaggio di distinguere il provirus intatto da quello difettivo.
Ad oggi esistono diverse tecniche che permettono non solo di valutare in maniera quantitativa la persistenza virale, ma anche la capacità del provirus di essere trascritto e/o tradotto. Ognuna di queste metodiche presenta dei vantaggi e dei limiti (Tabella 1). Attualmente il quantitative Viral Outgrowth Assay, noto come qVOA, e il più recente Intact Proviral DNA Assay (IPDA) rappresentano i metodi più utilizzati per studiare la persistenza di HIV (6,7). Il primo saggio permette di misurare il provirus capace di replicare, mentre l’altro ha il grande vantaggio di distinguere il provirus intatto da quello difettivo.
Grazie all’utilizzo delle suddette metodiche oggi sappiamo che la biologia del provirus replication competent differisce da quella del provirus difettivo. In generale, nei soggetti in ART il provirus intatto e difettivo diminuisce nel tempo, con un decay più rapido nei primi 7 anni di terapia. Tuttavia le cellule che albergano il DNA provirale replication competent mostrano una cinetica di riduzione più rapida rispetto alle cellule contenenti genomi difettivi (8). Il decay del serbatoio virale sembra essere influenzato anche dai diversi regimi terapeutici. Ad esempio è stato osservato che, rispetto ai regimi a base di NNRTI e INSTI, i regimi contenenti PI sono stati associati a un più lento declino del serbatoio provirale intatto (9).
Variabilità del decay del carico provirale
Dati interessanti sono emersi da uno studio recente dove è stato osservato che, in soggetti in ART da lungo tempo, il decay del provirus intatto può variare nei diversi soggetti (10). In particolare, gli autori di questo studio hanno osservato ben tre diversi andamenti. Le diverse cinetiche hanno in comune una rapida diminuzione nei primi 6-8 anni di terapia, ma successivamente la situazione può cambiare. In alcuni soggetti il decay continua anche se molto più lentamente, in altri alla rapida diminuzione segue una lunga fase di plateau e in altri ancora dopo il decay si assiste ad un reinnalzamento del carico provirale intatto.
L’osservazione di un marcato rallentamento o di un’inversione del decadimento del DNA provirale intatto durante la seconda decade di ART suggerisce che il meccanismo, attraverso il quale le cellule che albergano provirus intatti vengono eliminate, cambia nel corso della ART a lungo termine. Sebbene lo studio sia stato eseguito su un numero limitato di partecipanti, i dati ottenuti dimostrano ulteriormente che il fenomeno della persistenza di HIV è straordinariamente complesso. Una comprensione più dettagliata dei determinanti virali e dell’ospite coinvolti nel decadimento delle cellule con provirus intatti è necessaria per capire come, quando e se è possibile intervenire per accelerare il tasso di riduzione di queste cellule nella seconda fase. Nella caratterizzazione della persistenza di HIV aspetti interessanti emergono anche dagli studi che hanno preso in esame gli RNA virali cellula-associati (CA-RNA). La maggior parte dei genomi virali integrati sono trascrizionalmente attivi, ma pochi sono quelli che portano alla sintesi di prodotti maturi, suggerendo l’esistenza di un controllo post-trascrizionale della latenza. Inoltre, sebbene il DNA provirale difettivo non abbia alcun significato dal punto di vista della produzione di progenie virale, in quanto incapace di portare alla formazione di nuovo virus infettante, essendo trascrizionalmente attivo esso può essere espresso e può portare quindi alla sintesi di proteine difettive. La presenza e la persistenza di CA-RNA difettivi sembrano avere importanti implicazioni cliniche in quanto in soggetti virologicamente soppressi i livelli di questi specifici CA-RNA correlano con la conta delle cellule CD8+ e con la positività agli anticorpi verso le proteine di HIV, suggerendo un loro ruolo nella immunoattivazione persistente che caratterizza le PLWH in successo virologico (11).
In conclusione, negli ultimi anni sono stati compiuti grandi progressi nella caratterizzazione dei reservoir di HIV anche attraverso lo sviluppo di metodi per caratterizzare e quantificare il DNA provirale e il provirus replication competent che, come già ricordato, rappresenta la sorgente di virus dopo interruzione terapeutica.
La persistenza di HIV è però un fenomeno estremamente complesso; la possibilità di questo virus di esistere come DNA provirale in una varietà di cellule e tessuti di una persona infetta, rende difficile la sua individuazione e conseguentemente la sua eliminazione.
La possibilità di quantificare precisamente la dimensione del serbatoio come pure la conoscenza dei meccanismi alla base dello sviluppo della latenza rappresentano due elementi imprescindibili per intraprendere la strada verso l’eradicazione dell’infezione o per arrivare ad una cura funzionale.
- Eisinger RW, Dieffenbach CW, Fauci AS. HIV Viral Load and Transmissibility of HIV Infection: Undetectable Equals Untransmittable. JAMA. 2019;321(5):451-452.
- Colby DJ, Trautmann L, Pinyakorn S, et al. Rapid HIV RNA rebound after antiretroviral treatment interruption in persons durably suppressed in Fiebig I acute HIV infection. Nat Med. 2018;24(7):923-926.
- Eisele E, Siliciano RF: Redefining the viral reservoirs that prevent HIV-1 eradication. Immunity. 2012;37:377-388.
- Pasternak AO, Berkhout B. HIV persistence: silence or resistance? Curr Opin Virol. 2023;59:101301.
- Coffin JM, Hughes SH: Clonal expansion of infected CD4+ T cells in people living with HIV. Viruses. 2021;13:2078.
- Cicilionytė A, Berkhout B, Pasternak AO. Assessing proviral competence: current approaches to evaluate HIV-1 persistence. Curr Opin HIV AIDS. 2021;16(4):223-231.
- Einkauf KB, Osborn MR, Gao C. et al. Parallel analysis of transcription, integration, and sequence of single HIV-1 proviruses. Cell 2022; 185(2):266-282.
- Siliciano JD, Siliciano RF, Laird GM et al. Differential decay of intact and defective proviral DNA in HIV-1-infected individuals on suppressive antiretroviral therapy. JCI Insight. 2020;5(4):e132997.
- Darcis G, Berkhout B, Pasternak AO. Differences in HIV Markers between Infected Individuals Treated with Different ART Regimens: Implications for the Persistence of Viral Reservoirs. Viruses. 2020;12(5):489.
- Gandhi RT, Bosch RJ, Mar H, et al. AIDS Clinical Trials Group A5321 Team. Varied Patterns of Decay of Intact Human Immunodeficiency Virus Type 1 Proviruses Over 2 Decades of Antiretroviral Therapy. J Infect Dis. 2023; 227(12):1376-1380.
- Singh K, Natarajan V, Dewar R, et al. Long-term persistence of transcriptionally active ’defective’ HIV-1 proviruses: implications for persistent immune activation during antiretroviral therapy. AIDS 2023; 37(14):2119-2130.







