L’infezione da virus dell’epatite delta (HDV) rappresenta una complicanza significativa per le persone che vivono con infezione da HIV (PLWH). HDV è un virus a RNA difettivo che necessita dell’antigene di superficie S (HBsAg) del virus dell’epatite B (HBV) per la replicazione e l’infezione. In PLWH, l’infezione da HDV comporta un rischio aumentato di cirrosi epatica e di carcinoma epatocellulare, rispetto alla monoinfezione da HBV o alla coinfezione HBV/HDV (1). In questo contesto, è cruciale comprendere l’epidemiologia, le caratteristiche cliniche e le opzioni terapeutiche per l’infezione da HDV per ottimizzare la gestione di questa complessa triade di infezioni.
Epidemiologia
Secondo alcune recenti meta-analisi, più di 12 milioni di persone al mondo hanno incontrato il virus HDV, la cui prevalenza è pari al 5-10% nei soggetti HBsAg positivi (2). L’infezione da HDV è distribuita in modo eterogeneo a livello globale, con prevalenze particolarmente elevate in alcune regioni come il bacino del Mediterraneo, l’Africa sub-sahariana, il Medio Oriente e alcune parti dell’Asia (2).
Le ragioni alla base di queste variazioni geografiche includono sia la differente distribuzione dell’infezione da HBV, che dipende a sua volta dall’implementazione dei programmi di immunizzazione di massa e di gruppi ad alto rischio, sia la distribuzione dei fattori di rischio per l’infezione da HBV, a sua volta conseguenza di molteplici fattori socioeconomici, culturali, sanitari e comportamentali.
L’Italia è un paese a bassa endemicità per HBV, con prevalenza inferiore al 2%. La vaccinazione di routine dei nuovi nati e dei gruppi a rischio, le pratiche mediche sicure e i controlli rigorosi sulle trasfusioni di emoderivati hanno notevolmente ridotto il rischio di trasmissione di HBV e, di conseguenza, di HDV (3). In questo contesto, i fattori di rischio più frequenti includono principalmente comportamenti sessuali a rischio e utilizzo di sostanze stupefacenti per via endovenosa.
I PLWH rappresentano una popolazione ad alto rischio per infezione da HDV per la condivisione delle vie di trasmissione. In Europa, la prevalenza di HDV in PLWH è del 15%, di cui il 66% presenta HDV-RNA rilevabile a livello sierico (4). La prevalenza raggiunge il 50% nei soggetti con anamnesi positiva per utilizzo di sostanze stupefacenti per via endovenosa (4). In Italia, un’analisi della coorte ICONA (Italia cohort Naive Antiretrovirals) ha evidenziato una prevalenza di HDV pari al 18,8% dei soggetti con infezione da HIV/HBV testati (5). La maggior parte (67,1%) dei soggetti con triplice infezione aveva anamnesi positiva per utilizzo di sostanze stupefacenti per via endovenosa e il 67,7% di essi aveva HDV-RNA rilevabile a livello sierico (5). Tutti i soggetti testati avevano infezione da HDV genotipo 1 che, rispetto ad altri genotipi virali, risulta essere correlato ad aumentato rischio di progressione della malattia epatica a cirrosi e sue complicanze (5).
Questi dati, molto interessanti per comprendere l’attuale epidemiologia di HDV in Europa e in Italia, potrebbero tuttavia sovrastimare la prevalenza di HDV. Infatti, in entrambe le coorti più del 20% dei soggetti è stato escluso perché mai testato per HDV. Inoltre, in Italia cosi come nel resto d’Europa si è assistito negli ultimi anni ad uno shift nei fattori di rischio per infezione da HIV, con una netta riduzione del numero di infezioni correlate all’abuso di sostanze stupefacenti a fronte di un aumento dei casi riconducibili a rapporti sessuali a rischio (6). Non si può quindi escludere un bias di selezione con una sovrastima della prevalenza di HDV. Infatti, test sistematici potrebbero essere stati offerti a individui a più alta probabilità di infezione per il perpetuare di comportamenti a rischio e non in maniera omogenea a tutti i soggetti con infezione da HIV/HBV.
Clinica
In PLWH, l’infezione da HDV può portare a presentazione clinica severa, progressione rapida di malattia a cirrosi epatica e ad un aumentato rischio di eventi epatici di grado severo (decesso, scompenso epatico, necessità di trapianto epatico) rispetto a soggetti non esposti ad HDV (5).
Allo stesso modo il rischio di eventi epatici è quattro volte superiore in soggetti con nadir dei linfociti T CD4+ inferiore a 200/mmc. Quest’ultimo punto rispecchia verosimilmente il ruolo dell’immunosoppressione correlata all’infezione da HIV in soggetti con infezione da HBV, con o senza coinfezione HDV (5). Al contrario, dati su soggetti con positività anticorpale per HDV (indipendentemente dalla presenza di replicazione virale attiva) non hanno evidenziato un impatto negativo di HDV su risposta clinica, virologica o immunologica alla terapia antiretrovirale (7).
Diagnosi
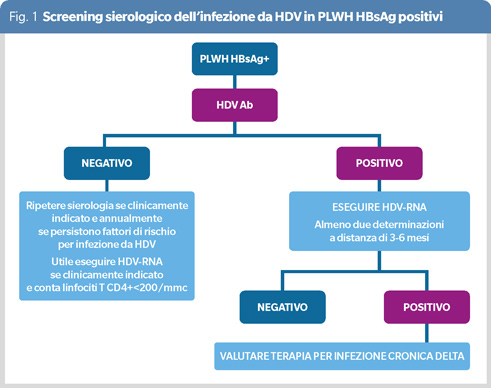 La presenza di anticorpi anti-HDV (IgG o Ig totali) identifica soggetti HBsAg positivi che sono stati esposti ad HDV. Le recenti linee guida della European Association for the Study of the Liver (EASL), hanno sottolineato che lo screening sierologico dell’infezione da HDV dovrebbe essere effettuato almeno una volta in tutti i soggetti HBsAg positivi e dovrebbe essere ripetuto se clinicamente indicato (ad esempio, in caso di incremento degli indici di citolisi epatica o scompenso epatico acuto su cronico), ma anche annualmente in soggetti a persistente rischio per infezione (Figura 1) (8).
La presenza di anticorpi anti-HDV (IgG o Ig totali) identifica soggetti HBsAg positivi che sono stati esposti ad HDV. Le recenti linee guida della European Association for the Study of the Liver (EASL), hanno sottolineato che lo screening sierologico dell’infezione da HDV dovrebbe essere effettuato almeno una volta in tutti i soggetti HBsAg positivi e dovrebbe essere ripetuto se clinicamente indicato (ad esempio, in caso di incremento degli indici di citolisi epatica o scompenso epatico acuto su cronico), ma anche annualmente in soggetti a persistente rischio per infezione (Figura 1) (8).
Siccome gli anticorpi HDV persistono anche dopo la clearance del virus, è necessario valutare la presenza di HDV-RNA su plasma o siero per confermare un’infezione da HDV attiva. Tuttavia, test standardizzati e validati per la determinazione di HDV-RNA non sono attualmente disponibili. Inoltre i livelli sierici di HDV-RNA fluttuano nel tempo e possono diventare temporaneamente non rilevabili. Questo rende più difficile sia effettuare valutazioni epidemiologiche precise, sia ottimizzare la gestione diagnostica e terapeutica dei soggetti con epatite cronica da HDV.
Per aumentare l’affidabilità del test è quindi necessario ripetere la ricerca di HDV-RNA almeno in due occasioni a distanza di 3-6 mesi prima di escludere la presenza di replicazione virale (8). È infatti possibile che, effettuando ciclicamente la ricerca di HDV-RNA, si identifichino soggetti con valori di HDV-RNA vicini ai cut-off di sensibilità dei test disponibili e a rischio di sviluppare cirrosi epatica HDV correlata. Le raccomandazioni per il monitoraggio della malattia epatica da HDV non differiscono in funzione dello status HIV. Tuttavia, in PLWH il rischio di complicanze epatiche sussiste anche in presenza di bassi livelli di replicazione virale, verosimilmente in relazione all’immunosoppressione correlata all’infezione da HIV, mentre in soggetti con infezione da HBV/HDV è stata evidenziata una correlazione tra livelli di HDV-RNA sierici superiori a 1000 IU/mL e outcome (5).
Terapia
In PLWH con coinfezione HBV/HDV un trattamento integrato di HIV e HBV è essenziale per ottimizzare i risultati clinici, prevenire complicanze gravi e migliorare la qualità della vita. I farmaci antiretrovirali oggi disponibili sono efficaci nel sopprimere la carica virale HIV e allo stesso tempo sono sicuri e ben tollerati.
Di conseguenza, oggi la terapia antiretrovirale è raccomandata per tutti i soggetti con infezione da HIV, a prescindere dalla situazione clinica e dalla conta dei linfociti T CD4+ (9). In assenza di specifiche indicazioni a posticipare l’inizio della terapia antiretrovirale di alcune settimane (come nel caso della meningite criptococcica), un rapido inizio della terapia, immediatamente dopo la diagnosi di infezione da HIV, è auspicabile. Inoltre, in questo setting le linee guida europee raccomandano la prescrizione di una terapia antiretrovirale che includa tenofovir (disoproxil o alafenamide) - a meno che non ci sia un’anamnesi positiva per intolleranza a tenofovir - in considerazione della sua duplice attività antivirale nei confronti sia di HIV che di HBV (9). Se presente coinfezione da virus dell’epatite C (HCV), è necessario effettuare il trattamento anti-HCV.
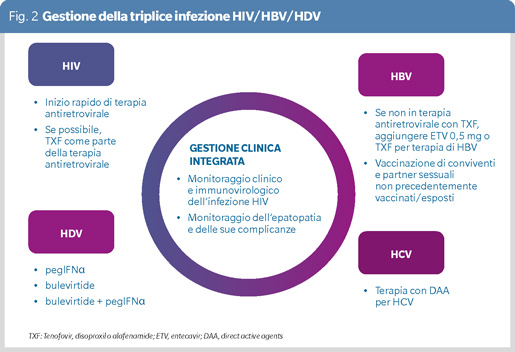 Tutti i soggetti con coinfezione HBV/HDV dovrebbero essere valutati per il trattamento HDV (8) (Figura 2). La valutazione dell’inizio della terapia antivirale per HDV è particolarmente importante in PLWH, in quanto a rischio di progressione più rapida della malattia epatica HBV/HDV correlata. Fino a poco tempo fa, interferone peghilato alfa (pegIFNα) era l’unica opzione terapeutica - peraltro off label in Italia - disponibile per HDV. Il trattamento con pegIFNα è limitato da bassi tassi di risposta virologica e alto rischio di eventi avversi. Recentemente, bulevirtide, un inibitore dell’ingresso di HBV e HDV negli epatociti, ha ricevuto l’approvazione di EMA per il trattamento di HDV ed è tuttora l’unico farmaco approvato in Italia per questa indicazione. In base alle linee guida EASL, bulevirtide andrebbe utilizzato al dosaggio di 2 mg al dì a lungo termine e può essere usato in combinazione con pegIFNα in soggetti senza intolleranza o controindicazioni all’interferone (8). I trial clinici di fase II e i risultati preliminari di un trial clinico di fase III, unitamente ad alcune esperienze real-life, hanno evidenziato che bulevirtide è ben tollerato ed è efficace nel ridurre i livelli circolanti di HDV-RNA e nel normalizzare le transaminasi (10-13). L’efficacia e la sicurezza di bulevirtide in PLWH non è tuttavia valutabile sulla base di questi dati. Infatti, mentre gli studi di fase II hanno escluso PLWH, lo studio di fase III ha incluso solo 2 PLWH che, come da criteri di inclusione del protocollo, presentavano al basale conta di linfociti T CD4+ superiore a 500/mmc e HIV-RNA non rilevabile da almeno 12 mesi.
Tutti i soggetti con coinfezione HBV/HDV dovrebbero essere valutati per il trattamento HDV (8) (Figura 2). La valutazione dell’inizio della terapia antivirale per HDV è particolarmente importante in PLWH, in quanto a rischio di progressione più rapida della malattia epatica HBV/HDV correlata. Fino a poco tempo fa, interferone peghilato alfa (pegIFNα) era l’unica opzione terapeutica - peraltro off label in Italia - disponibile per HDV. Il trattamento con pegIFNα è limitato da bassi tassi di risposta virologica e alto rischio di eventi avversi. Recentemente, bulevirtide, un inibitore dell’ingresso di HBV e HDV negli epatociti, ha ricevuto l’approvazione di EMA per il trattamento di HDV ed è tuttora l’unico farmaco approvato in Italia per questa indicazione. In base alle linee guida EASL, bulevirtide andrebbe utilizzato al dosaggio di 2 mg al dì a lungo termine e può essere usato in combinazione con pegIFNα in soggetti senza intolleranza o controindicazioni all’interferone (8). I trial clinici di fase II e i risultati preliminari di un trial clinico di fase III, unitamente ad alcune esperienze real-life, hanno evidenziato che bulevirtide è ben tollerato ed è efficace nel ridurre i livelli circolanti di HDV-RNA e nel normalizzare le transaminasi (10-13). L’efficacia e la sicurezza di bulevirtide in PLWH non è tuttavia valutabile sulla base di questi dati. Infatti, mentre gli studi di fase II hanno escluso PLWH, lo studio di fase III ha incluso solo 2 PLWH che, come da criteri di inclusione del protocollo, presentavano al basale conta di linfociti T CD4+ superiore a 500/mmc e HIV-RNA non rilevabile da almeno 12 mesi.
Due esperienze real-life hanno valutato l’efficacia di bulevirtide in PLWH. Nella prima sono stati inclusi 5 PLWH con coinfezione HBV/HDV affetti da cirrosi epatica ed ipertensione portale clinicamente significativa. Di questi, il 60% ha ottenuto una risposta combinata (virologica, con riduzione di HDV-RNA di almeno 2log, e biochimica con normalizzazione delle transaminasi) a 6 mesi dall’inizio della terapia (14). La seconda esperienza real-life, francese, ha incluso 38 soggetti con infezione da HIV, di cui il 68% affetto da cirrosi epatica, che hanno ricevuto terapia con bulevirtide con o senza pegIFNα in associazione, con buona tollerabilità. In questo studio, la risposta virologica combinata è stata del 25% e del 50%, rispettivamente in soggetti che hanno ricevuto monoterapia e terapia di combinazione, a 24 settimane, e del 36,8% e del 50% a 48 settimane (15). Per contro, bulevirtide necessita di essere somministrato per via sottocutanea e non è chiaro per quanto a lungo vada proseguito il trattamento. Questi fattori possono rappresentare ostacoli significativi all’aderenza alla terapia.
Per quanto riguarda il rischio di interazioni farmacologiche con la terapia antiretrovirale, è da notare che bulevirtide è eliminato tramite legame con NTCP. La cosomministrazione con inibitori di NTCP non è quindi raccomandata in quanto può alterare l’eliminazione di bulevirtide (16). Questa raccomandazione si applica a ritonavir, efavirenz e etravirina, ma anche a cobicistat, in quanto non è possibile escludere un suo effetto inibitorio su NTCP. È quindi necessario verificare il regime antiretrovirale in corso e le possibili alternative prima dell’inizio della terapia con bulevirtide.
Aderenza alla terapia
Una buona aderenza alla terapia è cruciale per ottenere il massimo beneficio dalle terapie antivirali. Sotto questo punto di vista, i soggetti in cura per infezione da HIV sono buoni candidati al trattamento per HDV in quanto la loro aderenza a controlli e terapie è valutata alla visite ambulatoriali per la gestione dell’infezione da HIV (10). Di conseguenza, al momento della proposta della terapia per HDV, i PLWH sono già edotti dell’importanza della corretta assunzione della terapia.
Conclusione
L’infezione da HDV in PLWH rappresenta una sfida clinica significativa e richiede un approccio integrato e multidisciplinare. La comprensione dell’epidemiologia, delle caratteristiche cliniche e delle opzioni terapeutiche è essenziale per migliorare l’outcome della triplice infezione HIV/HBV/HDV. La simultanea assunzione di terapia antiretrovirale, terapia per infezione da HBV e da HDV è necessaria per ottimizzare l’outcome del paziente, il quale è chiamato attivamente a partecipare al successo della terapia mantenendo un’aderenza massimale alla terapia in atto.
- Béguelin C, Moradpour D, Sahli R, et al. Swiss HIV Cohort Study Hepatitis delta-associated mortality in HIV/HBV-coinfected patients. J Hepatol. 2017;66:297303.
- Stockdale AJ, Kreuels B, Henrion MYR, et al. The global prevalence of hepatitis D virus infection: Systematic review and metaanalysis. J Hepatol. 2020;73:523-532.
- Stroffolini T, Stroffolini G. Vaccination Campaign against Hepatitis B Virus in Italy: A History of Successful Achievements. Vaccines (Basel). 2023;11:1531.
- Béguelin C, Atkinson A, Boyd A, et al. Hepatitis delta infection among persons living with HIV in Europe. Liver Int. 2023;43:819-828.
- d’Arminio Monforte A, Tavelli A, Salpini R, et al. Determinants of worse liver-related outcome according to HDV infection among HBsAg positive persons living with HIV: Data from the ICONA cohort. Liver Int. 2024;44:603-613.
- Nozza S, Cozzi-Lepri A, Bai F, et al. Proportion and factors associated with recent HIV infection in a cohort of patients seen for care in Italy over 1996-2014: Data from the ICONA Foundation Study cohort. PLoS One. 2017;12:e0189045.
- Sheng WH, Hung CC, Kao JH, et al. Impact of Hepatitis D Virus Infection on the Long-Term Outcomes of Patients with Hepatitis B Virus and HIV Coinfection in the Era of Highly Active Antiretroviral Therapy: A Matched Cohort Study, Clin Infect Dis. 2007;44: 988-995.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines on hepatitis delta virus. J Hepatol. 2023;79(2):433-460.
- EACS Guidelines version 12.0, October 2023. https://www.eacsociety.org/media/guidelines-12.0.pdf
- Wedemeyer H, Schneweis K, Bogomolov PO, et al. Final results of a multicenter, open-label phase 2 clinical trial (MYR203) to assess safety and efficacy of Myrcludex B in combination with PEG-interferon Alpha 2a in patients with chronic HBV/HDV co-infection. J Hepatol 2019;70 (Suppl 1):e81.
- Asselah A, Arama SS, Bogomolov P, et al. Safety and efficacy of bulevirtide monotherapy and in combination with Peginterferon alfa-2a in patients with chronic hepatitis delta: 24-week interim data of MYR204 Phase 2b study. J Hepatol, 2021;75 (Suppl 1):S291
- Wedemeyer H, Schöneweis K, Bogomolov P, et al. Safety and efficacy of bulevirtide in combination with tenofovir disoproxil fumarate in patients with hepatitis B virus and hepatitis D virus coinfection (MYR202): a multicentre, randomised, parallel-group, open-label, phase 2 trial. Lancet Infect Dis 2023;23:117-129.
- Wedemeyer H, Aleman S, Brunetto MR, et al. A Phase 3, Randomized Trial of Bulevirtide in Chronic Hepatitis D. N Engl J Med. 2023;389:22-32.
- Visco Comandini U, De Santis E, De Maria F, et al. "Real world" efficacy of bulevirtide in HBV/HDV-related cirrhosis including people living with HIV: Results from the compassionate use programme at INMI Spallanzani in Rome, Italy. HIV Med. 2023;24:1075-1082.
- de Lédinghen V, Fougerou-Leurent C, Le Pabic E, et al. Treatment with bulevirtide in HIV-infected patients with chronic hepatitis D: ANRS HD EP01 BuleDelta and compassionate cohort. JHEP Rep. 2024;6(8):101057.
- https://hep-druginteractions.org/checker







