I test diagnostici rapidi sono diventati un’alternativa per la diagnosi di molte malattie, dal diabete, alla malaria, all’HIV.
 Rispetto al prelievo tradizionale, a livello personale superano il problema della fobia della puntura venosa con l’ago, dell’indisponibilità di vene periferiche, del rischio di danno e trombosi delle vene stesse, del riuso di materiale non sterilizzato; a livello di salute pubblica facilitano la raccolta dei campioni di sangue in aree remote, in situazioni logistiche inaccessibili dai Servizi Sanitari, in contesti ambientali disagiati come le carceri, in pazienti spesso riluttanti come i tossicodipendenti e gli immigrati.
Rispetto al prelievo tradizionale, a livello personale superano il problema della fobia della puntura venosa con l’ago, dell’indisponibilità di vene periferiche, del rischio di danno e trombosi delle vene stesse, del riuso di materiale non sterilizzato; a livello di salute pubblica facilitano la raccolta dei campioni di sangue in aree remote, in situazioni logistiche inaccessibili dai Servizi Sanitari, in contesti ambientali disagiati come le carceri, in pazienti spesso riluttanti come i tossicodipendenti e gli immigrati.
Per la diagnosi dell’epatite virale si sono affermati negli ultimi anni test diagnostici per l’epatite B, C e D in macchie di sangue secco (dried blood spot, DBS) (1, 2). Di seguito è esposta la metodica di esecuzione del test e sono commentati la sua efficacia ed i suoi limiti (2).
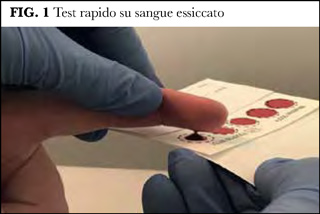
Il campione di sangue da esaminare si ottiene pungendo un dito (solitamente il medio) preferibilmente con una lancetta; un ago può rilasciare troppo poco sangue poiché ogni determinazione per marcatori d’epatite virale richiede circa 250 microlitri. Il sangue va raccolto direttamente a caduta su carta assorbente senza toccare la carta con la pelle per evitare contaminazioni cutanee (Figura 1). La macchia umida di sangue va lasciata essiccare. Una volta essiccato il sangue, la macchia secca va ritagliata e messa in una bustina che va etichettata ed aggiunta di sostanza igroscopica. Una volta arrivato al laboratorio, il campione di sangue secco è eluito dalla macchia in un tampone e dopo almeno un’ora di eluizione, ma preferibilmente dopo più ore, è pronto per l’analisi.
I vantaggi della tecnica DBS sul prelievo ordinario di sangue sono:
- il volume di sangue necessario per l’analisi è minore che in un campione venoso
- la tecnica è semplice, non invasiva, non richiede strumentazione o personale dedicato
- v’è un rischio minimo di contaminazione ed emolisi
- i campioni possono essere conservati a lungo senza refrigerazione e possono essere inviati per posta a centri d’analisi di riferimento.
 Vantaggi dimostrati del DBS sono la migliore accettabilità (rispetto anche ai test rapidi “salivari”) e quindi la maggior partecipazione. Lo svantaggio inevitabile rispetto al sangue prelevato per vena è la diluizione del campione. Poiché il campione di sangue diviene diluito con l’eluizione dal filtro, la sensibilità analitica è inferiore in DBS rispetto a quello ottenuto per puntura venosa. Nel siero da sangue venoso è possibile determinare l’HCV-RNA fino a 12 IU/mL, mentre in DBS la soglia inferiore di determinazione è di circa 2500 IU/mL (3).
Vantaggi dimostrati del DBS sono la migliore accettabilità (rispetto anche ai test rapidi “salivari”) e quindi la maggior partecipazione. Lo svantaggio inevitabile rispetto al sangue prelevato per vena è la diluizione del campione. Poiché il campione di sangue diviene diluito con l’eluizione dal filtro, la sensibilità analitica è inferiore in DBS rispetto a quello ottenuto per puntura venosa. Nel siero da sangue venoso è possibile determinare l’HCV-RNA fino a 12 IU/mL, mentre in DBS la soglia inferiore di determinazione è di circa 2500 IU/mL (3).
La riduzione di sensibilità va tenuta in conto nella interpretazione dei risultati; mentre questo è un problema minore nell’accertamento epidemiologico poiché nel 97% dei pazienti il titolo dell’HCV è in eccesso di 2500 IU/mLl, il test in DBS non è utile nel seguire le variazioni virali nei soggetti in terapia perché il titolo dell’HCV-RNA può scendere a livelli non determinabili in DBS ed ancora positivi in diagnostica ordinaria.
 Un ulteriore miglioramento analitico si ottiene con l’uso delle Plasma Separation Cards (PSC), che separano gli eritrociti dal plasma ed incorporano uno stabilizzatore di RNA (4).
Un ulteriore miglioramento analitico si ottiene con l’uso delle Plasma Separation Cards (PSC), che separano gli eritrociti dal plasma ed incorporano uno stabilizzatore di RNA (4).
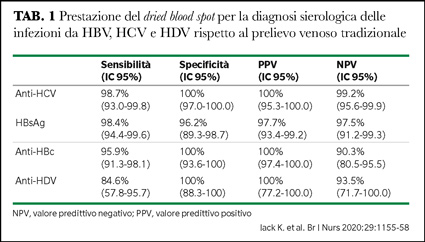
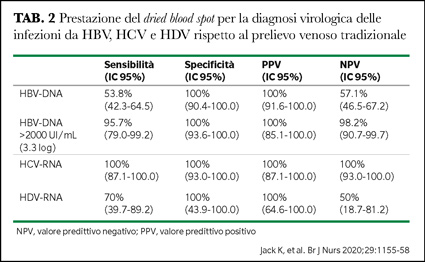
Le Tabelle 1 e 2 riportano i risultati in sierologia e virologia per HBV, HCV ed HDV con DBS su Plasma Separation Cards in 201 campioni positivi nel prelievo venoso standard raccolti da 124 pazienti HBsAg-positivi, da 75 anti-HCV positivi e da due positivi per entrambi i marcatori (5). Dei 124 pazienti
HBsAg-positivi, 13 (6.5%) avevano l’anticorpo anti-HD. La sensibilità/specificità è stata 98.4%/96.2% per l’HBsAg, 98.7%/100% per anti-HCV, e 84.6%/100% per anti-HD (Tabella 1). Solo 42 di 78 (53.8%) campioni con HBV-DNA erano quantificabili in DBS (Tabella 2); la sensibilità è aumentata al 95.7% nei pazienti con HBV-DNA >2000 IU/mL.
In un recente studio (6), l’HBV-DNA è stato rilevato in 50 di 70 (71.4%) DBS in sieri con una carica virale superiore a 200 IU/mL misurata con un test in house ed in 18 di 24 (75%) DBS in sieri con cariche virali superiori a 389 IU/mL misurate con un test commerciale.
- Soulier A, Poiteau L, Rosa I, et al. Dried blood spots: a tool to ensure broad access to hepatitis C screening, diagnosis, and treatment monitoring. J Infect Dis. 2016; 213:1087-95.
- Jack K, Irving WL. Using dried blood spot testing for diagnosing viral hepatitis. Br J Nurs. 2020; 29:1155-1158.
- Lange B, Cohn J, Roberts T, et al. Diagnostic accuracy of serological diagnosis of hepatitis C and B using dried blood spot samples (DBS): two systematic reviews and meta-analyses. BMC Infect Dis. 2017; 17(Suppl 1):700.
- Carmona S, Seiverth B, Magubane D, et al. Separation of plasma from whole blood by use of the cobas plasma separation card: a compelling alternative to dried blood spots for quantification of HIV-1 viral load. J Clin Microbiol. 2019; 57:e01336-18.
- Martínez-Campreciós J, Rando-Segura A, Buti M, et al. Reflex viral load testing in dried blood spots generated by plasma separation card allows the screening and diagnosis of chronic viral hepatitis. J Virol Methods. 2021; 289:114039.
- Jackson K, Holgate T, Tekoaua R, et al. Evaluation of dried blood spots for hepatitis B and D serology and nucleic acid testing. J Med Virol. 2022; 94:642-648.







