Nelle ultime decadi l’epidemiologia e la stessa espressione clinica delle infezioni sta cambiando in virtù di una maggior compromissione di base del paziente infetto, della comparsa e diffusione di patogeni un tempo poco conosciuti e, soprattutto, del progredire del fenomeno della antibioticoresistenza.
E’ ormai evidente che i progressi della medicina moderna abbiano consentito una duratura sopravvivenza ad una vasta popolazione di pazienti che una volta sarebbe venuta meno in poco tempo in virtù di malattie ad esito fatale. Si tratta però di soggetti “fragili” con elevato rischio infettivo, come i neoplastici in trattamento citostatico, i pazienti con malattie che richiedono terapia immunosoppressiva o gli stessi “grandi anziani” affetti da multiple comorbidità e conseguenti candidati a multiple terapie.
Molti di questi pazienti sono portatori di corpo estraneo che, di fatto, rappresenta un ennesimo fattore di rischio infettivo.
L’esposizione all’ambiente e, di conseguenza, all’ecosistema ospedaliero rappresenta un fattore di rischio di acquisizione, e potenziale successiva infezione, da germi antibiotico resistenti.
Alcuni di essi sono formidabili patogeni classici, quali Staphylococcus aureus, altri sono oggi i nuovi agenti di infezione per i pazienti defedati sopra descritti. Si pensi che, decadi orsono, questi ultimi microrganismi erano ritenuti del tutto innocui. Ad esempio, Serratia marcescens (un tempo Bacillus prodigiosus) era usata volontariamente da ricercatori che la assumevano per esperimenti volti a documentare il comportamento delle goccioline di Flugge.
Mima polymorpha era il nome con cui veniva identificato Acinetobacter baumannii, quando veniva isolato dal perineo e dismesso tranquillamente come saprofita, non senza un certo sollievo perché veniva esclusa Neisseria gonorrhoeae, cui somigliava al primo esame microscopico. Oggi sappiamo bene cosa significa una infezione nosocomiale da Acinetobacter carbapenem resistente!
Terapia antibiotica empirica: un “circolo” vizioso
 A questo punto invito il lettore ad esaminare in maniera “dinamica” la Figura 1 che rappresenta cosa può succedere a un paziente “fragile” quando viene ospedalizzato per una infezione che, almeno inizialmente, viene trattata con terapia antibiotica empirica: la parte centrale della figura con colori diversi mostra i momenti seriali dell’effetto della pressione antibiotica (color rosso), della attivazione dei meccanismi di resistenza antibiotica (verde), in germi antibiotico resistenti, prima colonizzanti (grigio) poi infettanti (giallo)….e dalla nuova infezione contratta in ospedale ricomincia e si ripercorre il “ciclo pericoloso”, giro dopo giro del cerchio centrale, con nuove terapie antimicrobiche e potenziali superinfezioni subentranti fino a culminare con la micosi sistemica.
A questo punto invito il lettore ad esaminare in maniera “dinamica” la Figura 1 che rappresenta cosa può succedere a un paziente “fragile” quando viene ospedalizzato per una infezione che, almeno inizialmente, viene trattata con terapia antibiotica empirica: la parte centrale della figura con colori diversi mostra i momenti seriali dell’effetto della pressione antibiotica (color rosso), della attivazione dei meccanismi di resistenza antibiotica (verde), in germi antibiotico resistenti, prima colonizzanti (grigio) poi infettanti (giallo)….e dalla nuova infezione contratta in ospedale ricomincia e si ripercorre il “ciclo pericoloso”, giro dopo giro del cerchio centrale, con nuove terapie antimicrobiche e potenziali superinfezioni subentranti fino a culminare con la micosi sistemica.
La Figura ci fa intendere come elemento determinante la risposta alla terapia di infezioni gravi al punto di giungere alla ospedalizzazione sia non solo l’efficacia della terapia antibiotica in termini di rapidità dell’effetto battericida ma anche il numero di procedure (impianto di cateteri endovascolari, imprescindibile in alcuni casi in cui sono richieste multiple somministrazioni giornaliere, posizionamento non sempre indicato del catetere vescicale, etc) e la durata di esposizione all’ambiente nosocomiale. In questo ambiente i pazienti immunodepressi acquisiscono i patogeni nosocomiali e i grandi anziani sviluppano la “sindrome da allettamento”.
I nuovi long acting
La Tabella 1 illustra le caratteristiche degli antibiotici long acting, definiti di proposito “rivoluzionari” proprio per le opportunità di gestione terapeutica che offrono in virtù della loro lunga emivita.
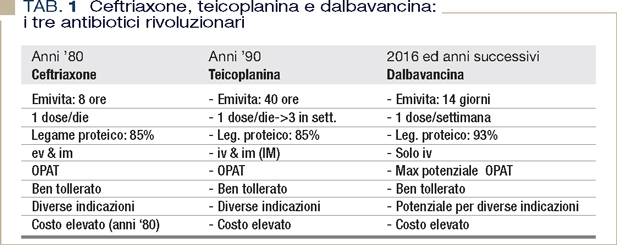
Di fatto, quando negli anni ’80 si introdusse nell’armamentario farmaceutico ceftriaxone si parlò subito di antibiotico “rivoluzionario”. Basta in tal senso immaginare lo stupore di passare per infezioni gravi, quali la meningite e l’endocardite, dalla infusione continua o intermittente sei volte al dì con penicillina G o con ampicillina alle due dosi/monodose al dì con ceftriaxone. Ancora oggi tale farmaco rimane all’avanguardia per la terapia delle infezioni streptococciche, da Neisseria spp, ed è considerata come possibile opzione della terapia di mantenimento di infezioni da Staphylococcus meticillino sensibile (1), anche se ha perso gran parte del suo “fascino” per l’emergenza tra le enterobacteriaceae di stipiti ceftriaxone-resistenti in virtù della produzione di betalattamasi ad ampio spettro o ESBL.
Negli anni ’90 la “rivoluzione” degli antibiotici a lunga emivita continuò con teicoplanina. Il farmaco si dimostra adeguato per diverse infezioni da Gram-positivi, comprese batteriemie, infezioni di cute e tessuti molli, polmoniti, alcune forme di endocardite, e diventa una prima scelta per infezioni di ossa ed articolazioni. Soprattutto nei confronti di queste ultime infezioni, si realizza in pieno la gestione domiciliare (cosiddetta “out patient therapy” o OPAT) con uno schema ormai classico delle tre somministrazioni settimanali (2).
Nuovi lipoglicopeptidi: dalbavancina
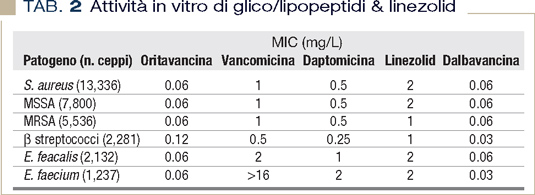 Oggi, i farmaci rivoluzionari sono i nuovi lipoglicopeptidi oritavancina e dalbavancina, dotati di una emivita che supera la settimana. Dal momento che la prima non è al momento disponibile in Italia si farà riferimento solo alla seconda. Si tratta di un lipoglicopeptide con uno spettro di azione paragonabile a quello di vancomicina e daptomicina (Tabella 2), con caratteristiche di intensa batteriocidia molto simili alla seconda ed attività superiore ad entrambe nei confronti di stipiti enterococcici vancomicina resistenti, stipiti stafilococcici con ridotta sensibilità a vancomicina e/o resistenti a linezolid, o altri batteri gram-positivi multiantibiotico- resistenti emergenti come Corynebacterium jeikeium e Corynebacterium striatum (3).
Oggi, i farmaci rivoluzionari sono i nuovi lipoglicopeptidi oritavancina e dalbavancina, dotati di una emivita che supera la settimana. Dal momento che la prima non è al momento disponibile in Italia si farà riferimento solo alla seconda. Si tratta di un lipoglicopeptide con uno spettro di azione paragonabile a quello di vancomicina e daptomicina (Tabella 2), con caratteristiche di intensa batteriocidia molto simili alla seconda ed attività superiore ad entrambe nei confronti di stipiti enterococcici vancomicina resistenti, stipiti stafilococcici con ridotta sensibilità a vancomicina e/o resistenti a linezolid, o altri batteri gram-positivi multiantibiotico- resistenti emergenti come Corynebacterium jeikeium e Corynebacterium striatum (3).
Dalbavancina è stata registrata, e come tale è in commercio, come terapia in due dosi (1.000 mg ev giorno 1 e 500 mg ev giorno 8) o singola dose (1.500 mg ev) per il trattamento di infezioni di cute e tessuti molli con una efficacia pari e una percentuale minore di effetti collaterali rispetto al trattamento standard con vancomicina ev seguito da linezolid orale (4).
L’utilizzo nella pratica clinica
Nella vita reale però le prime esperienze europee documentano che solo nel 21-23% dei casi viene impiegata per l’indicazione registrata (5). Nella stessa percentuale di casi vengono trattate infezioni endovascolari quali batteriemie catetere venoso centrale-correlate ed endocarditi a basso rischio embolico (in questo caso come terapia di mantenimento che consente una dimissione ospedaliera precoce del paziente). Infatti in più della metà dei casi vengono trattate con questo farmaco infezioni dell’osso e articolazioni, comprese (nuovamente in circa la metà dei casi) infezioni di protesi or topedica: i risultati preliminari sono assolutamente favorevoli a questo uso “off label” di dalbavancina con successi clinici superiori al 85-90%.
Infezioni osteoarticolari: dai dati preclinici agli studi
Quali sono le evidenze farmacocinetiche e il regime posologico raccomandato? Il primo punto è stato suffragato dai risultati di studi sia nell’uomo che in animali che documentano una ottima concentrazione del farmaco nell’osso e nelle strutture articolari. In particolare, in una esperienza di fase 2, condotta in 30 pazienti, suddivisi in 6 gruppi di 5 pazienti, è stata testata la concentrazione di farmaco nella compagine sia ossea che sinoviale a diversi intervalli di tempo dalla somministrazione di dalbavancina.
Una elaborazione statistica ha consentito di stabilire che uno schema di somministrazione che prevede 1.500 mg ev il giorno 1 e altrettanti il giorno 8 consente una concentrazione osteoarticolare terapeuticamente valida per un periodo di 8 settimane (6).
La correttezza di questa simulazione farmacocinetica è stata recentemente validata da uno studio prospettico presentato al Congresso della European Society of Clinical Microbiology and Infectious Diseases (ECCMID) tenutosi a Madrid ad aprile 2018 (7). Ottanta pazienti con osteomielite sono stati randomizzati 7:1 a ricevere dalbavancina secondo lo schema riportato (70 pazienti) oppure la miglior terapia standard (10 pazienti).
Le risposte cliniche favorevoli a 21, 28, 42, 180 giorni sono state simili nei due gruppi ed in particolare, dei 60 pazienti del gruppo dalbavancina valutati a 365 giorni, il 94% risultava guarito (7).
L’impressione è che tale schema di due dosi possa rivelarsi efficace anche per infezioni endovascolari quali le endocarditi streptococciche (6).
In conclusione, oggi disponiamo di farmaci realmente long acting con intensa attività battericida anti Gram-positivi, come dalbavancina e oritavancina.
Il valore aggiunto di questi farmaci non risiede solo nella efficacia terapeutica, ma anche nella opportunità di gestione extraospedaliera di infezioni di difficile trattamento con gli intuibili risparmi della spesa sanitaria e la ridotta esposizione dei pazienti più fragili ai patogeni nosocomiali.
Bibliografia
- Lowe RA, Barber KE, Wagner JL, et al. Ceftriaxone for the Treatment of Methicillin-susceptible Staphylococcus aureus Bacteremia: A Case Series. J Pharmacol Pharmacother. 2017 Jul-Sep; 8(3):140-144.
- Graninger W, Presterl E, Wenisch C, et al. Management of serious staphylococcal infections in the outpatient setting. Drugs 1997; 54 Suppl 6:21-8.
- Crotty MP, Krekel T, Burnham CA, et al. New Gram-Positive Agents: the Next Generation of Oxazolidinones and Lipoglycopeptides. J Clin Microbiol 2016; 54:2225-32.
- Dunne MW, Puttagunta S, Giorgdano P, al. A Randomized Clinical Trial of Single-Dose Versus Weekly Dalbavancin for Treatment of Acute Bacterial Skin and Skin Structure Infection Clin Infect Dis. 2016; 62: 545-551.
- Bouza E, Valerio M, Soriano A, et al. Dalbavancin in the treatment of different Gram-positive infections: a real-life experience. Int J Antimicrob Agents 2018: on line early (article in press).
- Dunne MW, Puttagunta S, Sprenger CR, et al. Extended-duration dosing and distribution of dalbavancin into bone and articular tissue. Antimicrob. Agents Chemother. 2015; 59:1849-1855.
- Rappo U, Shevchenko V, Shevchenko O, et al. Long-term outcomes of dalbavancin for the treatment of osteomyelitis in adult patients. 28th ECCMID, Madrid, Spain 22-24 April 2018. Asbract O0697.







