La resistenza ai carbapenemi tra i batteri Gram-negativi è uno dei principali problemi di salute pubblica globale a livello mondiale. L’Organizzazione Mondiale della Sanità pone i patogeni con questo profilo nella categoria “critical priority”, ovvero quella per cui si devono massimizzare gli sforzi per cercare nuove soluzioni terapeutiche (1).
Klebsiella pneumoniae ed Escherichia coli rappresentano l’esempio paradigmatico nell’ambito delle Enterobacteriaceae, ovvero la famiglia principale dell’ordine Enterobacterales. Nel caso delle carbapanem-resistant Enterobacteriaceae (CRE) si parla di resistenza ai carbapenemi in caso di mancata sensibilità ad almeno un farmaco di questa classe o in caso di accertata produzione di carbapenemasi (2).
Meccanismi di resistenza dei CRE: un panorama variegato
La resistenza ai carbapenemi nei Gram-negativi può derivare da differenti meccanismi (Figura 1).
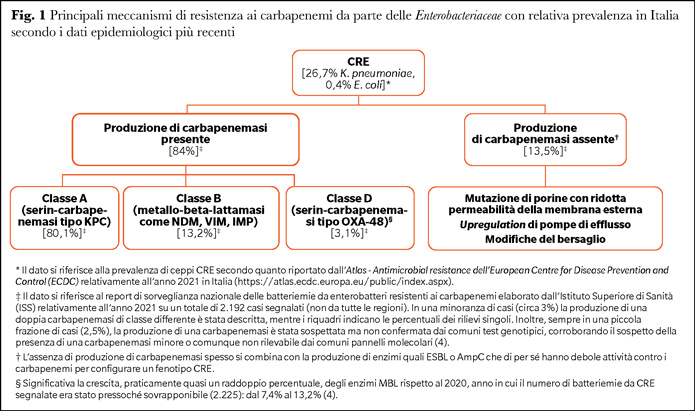
Dal punto di vista epidemiologico, l’impatto maggiore è legato alla produzione di carbapenemasi, la cui classificazione più nota rimanda allo schema di Ambler (3): in Italia l’enzima più diffuso è KPC (Figura 1) (4). Il carattere insidioso delle carbapenemasi è legato alla loro acquisizione per trasferimento genico orizzontale, dacché i geni di resistenza si trovano in genere su elementi mobili quali i plasmidi. Ciò spiega la pericolosità in termini di rischio di diffusione in ambito nosocomiale. Ancora, la produzione di carbapenemasi è associata ad alti livelli di resistenza ai carbapenemi, mentre il coinvolgimento di altri meccanismi può produrre fenotipi con resistenza più sfumata: per esempio, sensibilità conservata a meropenem ma non a ertapenem. Parziale eccezione sono carbapenemasi come OXA-48, che presentano un’attività intrinseca anti-carbapenemi abbastanza debole, ma spesso si associano alla presenza di altri meccanismi di resistenza.
Dal genotipo al fenotipo
Conoscere il genotipo del ceppo CRE è molto importante alla luce della complessa evoluzione che si è avuta nel tempo circa l’armamentario terapeutico, che si è espanso significativamente grazie all’introduzione di una nuova generazione di farmaci: in special modo, nuovi beta-lattamici includenti anche combinazioni precostituite con inibitori delle beta-lattamasi capaci di ripristinare l’attività anti-CRE di molecole quali gli stessi carbapenemi (5). Possiedono attività anti-CRE anche nuovi agenti di altre classi farmacologiche, quali plazomicina (aminoglicosidi) ed eravaciclina (tetracicline); tuttavia, in questa sede ci si concentrerà solo su farmaci disponibili per uso clinico in Italia.
Il punto è che le principali carbapenemasi, oltre i carbapenemi, idrolizzano pure penicilline, cefalosporine, monobattami (nel caso di KPC); inoltre, mostrano vari gradi di sensibilità ai vecchi e soprattutto ai nuovi inibitori delle beta-lattamasi.
Risulta pertanto di fondamentale importanza conoscere il meccanismo di resistenza. Ovviamente, il dato di sensibilità da antibiogramma permette di evincere il verosimile meccanismo implicato e soprattutto di fornire la scelta terapeutica più appropriata: i problemi sono la possibile mancata tempestività del dato di suscettibilità e la potenziale assenza in molti centri del testing per i nuovi farmaci nelle card dei sistemi automatizzati di determinazione della sensibilità agli antibiotici.
Dunque, rilevare la presenza di geni di resistenza associati a determinate carbapenemasi permette, nelle more del dato fenotipico definitivo, di orientare velocemente la scelta terapeutica, in particolar modo nei pazienti critici: ormai vi sono diversi pannelli sindromici molecolari che permettono in 1-5 ore di rilevare, da campioni quali sangue e materiale delle basse vie aeree, sia i principali patogeni che i più importanti geni di resistenza dal punto di vista clinico (5).
La ben nota esistenza di potenziali discordanze genotipo-fenotipo (es., rilevazione di gene KPC in ceppo pienamente sensibile ai carbapenemi, come da mancata espressione genica, coltura mista o sottopopolazione eteroresistente) e il fatto che tali pannelli siano limitati nel numero di patogeni e geni identificabili rende comunque indispensabile l’antibiogramma fenotipico standard, possibilmente allargato al più elevato numero di nuovi agenti terapeutici, pur con tutte le difficoltà tecniche che alcuni farmaci implicano, come la necessità di terreni di coltura ferro-depleti per cefiderocol (6).
Il perché di un approccio carbapenem-sparing per le infezioni da CRE
Sembra un controsenso, ma in realtà per molti anni, fino appunto all’avvento dei nuovi farmaci, i carbapenemi hanno rappresentato una delle armi di più comune utilizzo contro le infezioni da CRE. Due in particolar modo le strategie impiegate:
- l’uso in combinazione, specialmente nell’ambito di regimi imperniati su colistina, di carbapenemico ad alte dosi, in genere meropenem (6 g/die in infusione estesa o continua) in presenza di isolati con minimal inhibitory concentration (MIC) non superiore a 8 mg/L ma talora anche alzando il limite a 32 mg/L (7)
- l’associazione tra due carbapenemici (il cosiddetto “doppio carbapenemico”), sfruttando usualmente ertapenem come inibitore suicida data la sua spiccata affinità per le carbapenemasi, così da favorire l’azione per esempio di meropenem a dosi massimizzate (8).
Ormai questi sono approcci da considerare solo come extrema ratio in caso di impossibilità a utilizzare opzioni terapeutiche più recenti; tuttavia, i carbapenemi sono rientrati in gioco contro i ceppi CRE grazie ai nuovi inibitori delle beta-lattamasi: le combinazioni precostituite oggi a disposizione sono meropenem/vaborbactam e imipenem/relebactam, entrambe con spiccata attività anti-KPC, non invece contro enzimi quali OXA-48 e metallo-beta-lattamasi; usualmente la sensibilità è conservata per ceppi non-produttori di carbapenemasi.
Un approccio carbapenem-sparing si può giustificare nel cercare di ridurre la pressione selettiva e spezzare il circolo vizioso che è alla base dell’acquisizione di ceppi CRE, per cui l’utilizzo dei carbapenemi è un forte fattore di rischio come ampiamente dimostrato in letteratura (9).
Naturalmente, questo tipo di strategia ha un senso solo se coordinata, in un contesto più ampio, con altre misure finalizzate a contenere a tutti i livelli l’utilizzo dei carbapenemi, per esempio in empirico laddove non sussistano criteri per ricorrere al loro ampio coverage: a tal proposito, è da incentivare l’utilizzo di risk scoring tools, da adattare alla propria realtà locale, per stimare per esempio la probabilità di infezione da Enterobacterales produttrici di beta-lattamasi a spettro esteso (10).
Un algoritmo terapeutico carbapenem-sparing per le infezioni da CRE
Va da sé che può essere lo stesso meccanismo di resistenza a orientare verso scelte che escludano l’utilizzo di opzioni come meropenem/vaborbactam e imipenem/relebactam: è il caso di carbapenemasi quali MBL e OXA-48.
In Figura 2 è raffigurata una potenziale proposta di algoritmo terapeutico anti-CRE fondata su un approccio carbapenem-sparing alla luce delle più recenti linee guida nazionali (11) e internazionali (europee e statunitensi) (2,7).

Da questo approccio vengono così esclusi a priori meropenem/vaborbactam e imipenem/relebactam e viene inoltre esclusa la possibilità di utilizzo di meropenem ad alte dosi per quei casi di infezione da CRE non produttore di carbapenemasi in cui la sensibilità al farmaco resti conservata: è il caso di ceppi resistenti a ertapenem ma non a meropenem.
Con l’avvento dei nuovi farmaci l’orientamento è quello di preferire una monoterapia a strategie di combinazione: in tal senso ceftazidime/avibactam costituisce la scelta di riferimento, anche alla luce della maggiore quantità di dati a disposizione e della maggiore “anzianità di servizio” del farmaco. In una ampia coorte italiana di infezioni da K. pneumoniae produttrice di KPC la monoterapia con ceftazidime/avibactam non ha dato outcome inferiori rispetto all’utilizzo dello stesso farmaco in combinazione con un altro farmaco attivo (mortalità a 30 giorni 26.1% vs. 25%) (12). Il ricorso a un’associazione diventa però scelta pressoché obbligata nel caso di infezioni da ceppi produttori di metallo-enzimi: in tal caso si sfrutta l’attività anti-MBL di aztreonam e la protezione offerta da avibactam nei confronti di altri enzimi che idrolizzerebbero aztreonam stesso. In attesa dell’arrivo in pratica clinica della combinazione che le unisce, la combinazione al momento si effettua somministrando aztreonam più ceftazidime/avibactam (13).
Cefiderocol rappresenta una valida alternativa in tutti questi scenari.
Nel caso di infezioni non gravi, anche in un’ottica di stewardship dei nuovi farmaci che pure hanno un costo, oltre al rischio di un abuso con insorgenza di resistenze, è ragionevole ricorrere ad altre opzioni tra i cosiddetti vecchi farmaci sulla base del profilo di sensibilità, del sito di infezione e delle caratteristiche farmacocinetiche/farmacodinamiche delle molecole attive. In caso di infezioni delle vie urinarie, aminoglicosidi o la formulazione endovenosa di fosfomicina in monoterapia possono difatti essere un approccio ragionevole.
Nel caso di infezioni severe (sepsi, batteriemie, polmoniti), qualora non si possano usare i nuovi farmaci (indisponibilità, problemi di allergia – circa ceftazidime e cefiderocol per esempio vi è alto rischio di allergia crociata in virtù di un’identica catena laterale R1), è ragionevole utilizzare invece regimi di combinazione, sempre ricorrendo a farmaci attivi e seguendo principi di farmacocinetica/farmacodinamica per somministrare i farmaci migliori a seconda della sede di infezione.
Considerazione finale
Un approccio carbapenem-sparing, per quanto sensato in linea teorica, non deve diventare un limite. Specialmente alla luce dell’emergere di varianti KPC resistenti a ceftazidime/avibactam, poter e saper utilizzare risorse quali meropenem/vaborbactam e imipenem/relebactam amplia significativamente il ventaglio di possibilità terapeutiche efficaci per il paziente.
- Tacconelli E, Carrara E, Savoldi A, et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis. 2018; 18: 318-327.
- Tamma PD, Aitken SL, Bonomo RA, et al. Infectious Diseases Society of America 2022 Guidance on the Treatment of Extended-Spectrum β-lactamase Producing Enterobacterales (ESBL-E), Carbapenem-Resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with Difficult-to-Treat Resistance (DTR-P. aeruginosa). Clin Infect Dis. 2022; 75:187-212.
- Retamar-Gentil P, Cantón R, Abril López de Medrano V, et al. Awad SS, Rodriguez AH, Chuang Y-C, et al. Antimicrobial resistance in Gram-negative bacilli in Spain: an experts' view. Rev Esp Quimioter. 2023; 36: 65-81.
- Iacchini S, Caramia A, Fadda G, et al. CRE: sorveglianza nazionale delle batteriemie da enterobatteri resistenti ai carbapenemi. Dati 2021. Roma: Istituto Superiore di Sanità; 2022. (Rapporti ISS Sorveglianza RIS-2/2022)
- Giacobbe DR, Di Pilato V, Karaiskos I, et al. Treatment and diagnosis of severe KPC-producing Klebsiella pneumoniae infections: a perspective on what has changed over last decades. Ann Med. 2023; 55: 101-113.
- Yee R, Dien Bard J, Simner PJ. The Genotype-to-Phenotype Dilemma: How Should Laboratories Approach Discordant Susceptibility Results? J Clin Microbiol. 2021; 59: e00138-20.
- Paul M, Carrara E, Retamar P, et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin Microbiol Infect. 2022; 28: 521-547.
- Karakonstantis S, Kritsotakis EI, Gikas A. Treatment options for K. pneumoniae, P. aeruginosa and A. baumannii co-resistant to carbapenems, aminoglycosides, polymyxins and tigecycline: an approach based on the mechanisms of resistance to carbapenems. Infection. 2020; 48: 835-851.
- van Loon K, Voor In 't Holt AF, Vos MC. A Systematic Review and Meta-analyses of the Clinical Epidemiology of Carbapenem-Resistant Enterobacteriaceae. Antimicrob Agents Chemother. 2017; 62: e01730-17.
- Li C, Claeys KC, Justo JA, et al. No Crystal Ball? Using Risk Factors and Scoring Systems to Predict Extended-Spectrum Beta-Lactamase Producing Enterobacterales (ESBL-E) and Carbapenem-Resistant Enterobacterales (CRE) Infections. Current Infectious Disease Reports. 2022; 24: 147–158.
- Tiseo G, Brigante G, Giacobbe DR, et al. Diagnosis and management of infections caused by multidrug-resistant bacteria: guideline endorsed by the Italian Society of Infection and Tropical Diseases (SIMIT), the Italian Society of Anti-Infective Therapy (SITA), the Italian Group for Antimicrobial Stewardship (GISA), the Italian Association of Clinical Microbiologists (AMCLI) and the Italian Society of Microbiology (SIM). Int J Antimicrob Agents. 2022; 60: 106611.
- Tumbarello M, Raffaelli F, Giannella M, et al. Ceftazidime-Avibactam Use for Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae Infections: A Retrospective Observational Multicenter Study. Clin Infect Dis. 2021; 73: 1664-1676.
- Mauri C, Maraolo AE, Di Bella S, et al. The Revival of Aztreonam in Combination with Avibactam against Metallo-β-Lactamase-Producing Gram-Negatives: A Systematic Review of In Vitro Studies and Clinical Cases. Antibiotics (Basel). 2021; 10: 1012.







