La Colangite biliare primitiva (CBP) è una malattia immunomediata che colpisce prevalentemente soggetti di sesso femminile e che ha visto numerose donne coinvolte nel definirne le caratteristiche cliniche ed immunologiche.
Nel 1959 Dame Sheila Sherlock pubblica la prima serie di 42 soggetti affetti da quella che allora si definiva Cirrosi biliare primitiva. Nel 1965 Deborah Doniach individua negli anticorpi anti-mitocondrio (AMA) un marcatore sensibile e specifico della CBP. Nel 1988 Judy Van de Water insieme ad E. Gershwin identifica in frazioni della deidrolipoamide acetiltransferasi l’autoantigene degli AMA.
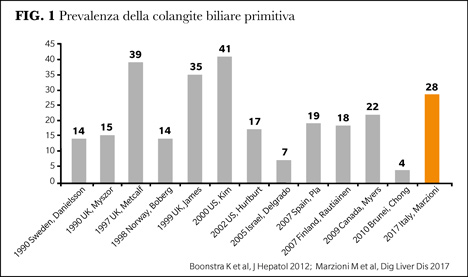 La facilità di diagnosi derivata dalla disponibilità di un test sierologico ha fatto sì che la malattia abbia incrementato incidenza e prevalenza e modificato le sue caratteristiche alla diagnosi, essendo diagnosticata in fasi molto più precoci e spesso asintomatiche (Figura 1). Solo nel 2015 però si è riusciti a modificarne il nome da cirrosi a colangite biliare primitiva.
La facilità di diagnosi derivata dalla disponibilità di un test sierologico ha fatto sì che la malattia abbia incrementato incidenza e prevalenza e modificato le sue caratteristiche alla diagnosi, essendo diagnosticata in fasi molto più precoci e spesso asintomatiche (Figura 1). Solo nel 2015 però si è riusciti a modificarne il nome da cirrosi a colangite biliare primitiva.
Nondimeno la definizione di CBP non è cambiata “…una malattia cronica colestatica, che colpisce prevalentemente donne di mezza età, caratterizzata da distruzione dei dotti biliari interlobulari e settali e da presenza in circolo di anticorpi anti-mitocondrio.”
Istologicamente la CBP si caratterizza per un danno immunomediato dei dotti biliari periferici, con formazione di granulomi e obliterazione del dotto, da cui deriva ostruzione al flusso di bile, accumulo di sali biliari, necrosi e infiammazione degli epatociti a monte dell’ostruzione, che sfocia in cirrosi biliare zonale. Il progredire del danno conduce ad un deterioramento della funzione epatica che si traduce in riduzione di qualità e aspettativa di vita, ove la presenza di sintomi – prevalentemente prurito e ittero – espressione di malattia avanzata condizionano una ulteriore riduzione dell’aspettativa di vita (14 anni asintomatici/9 anni sintomatici).
La diagnosi di CBP – in presenza di colestasi, AMA e assenza di dilatazione ecografica delle vie biliari – è semplice e non richiede conferma istologica.
Se gli AMA sono negativi e non sono presenti gli anticorpi anti-nucleo CBP specifici (anti-SP 100/anti-GP210) è necessario dimostrate la pervietà dei dotti biliari con Colangio-RM e in caso di negatività procedere con la biopsia epatica (3).
La CBP associa con altre patologie autoimmuni o immunomediate (Sjogren 32-70% - CREST/sclerosi sistemica 30-35%, fibrosi polmonare 29-39%, tiroidite 10%, celiachia 6%) e può essere complicata da osteoporosi (15-52%). Inoltre può esordire associata ad epatite autoimmune (AIH) o nel suo decorso sviluppare stigmate AIH, così come l’AIH può sviluppare stigmate di CBP.
I primi approcci terapeutici della CBP vedevano protagonisti farmaci intesi a controllarne la componente immunomediata (steroidi, azatioprina, ciclosporina), la fibrosi (colchicina), i sintomi (fenobarbital e rifampicina per il prurito) o le complicanze (vitamina D per l’osteoporosi); ma nel 1987 Raoul Poupon, prendendo spunto dall’evidenza che i portatori di calcoli della colecisti trattati con acido ursodesossicolico (UDCA) manifestavano una riduzione degli indici di citolisi e colestasi, pubblica uno studio in cui si dimostra che nella CBP l’UDCA riduce GGT, APh e bilirubina.
L’efficacia biochimica dell’UDCA veniva confermata in studi randomizzati controllati dallo stesso Poupon (1991), alla Mayo Clinic da K. Lindor (1994), in Canada da J. Heathcote (1994) e da B. Combes a Barcellona (1995). Nessuno di questi studi – preso singolarmente – era in grado di evidenziarne l’efficacia su endpoint robusti, ma aggregando i dati dei primi tre studi si evidenziava una riduzione di circa la metà del rischio di trapianto/morte. Da allora l’UDCA è diventato – alla dose 13-15 mg/Kg – il caposaldo terapeutico della CBP.
Studi successivi ne hanno confermato la capacità di incrementare la sopravvivenza, ottenendosi a 20 anni dall’inizio della somministrazione un tasso di sopravvivenza libera da trapianto del 66% (a titolo di curiosità uno studio precedente che arruolava soggetti non trattati con UDCA evidenziava un tasso di sopravvivenza analogo del 60% ma... a 10 anni). Non solo ma nei soggetti trattati in stadio precoce (stadio istologico 1-2 Scheuer) la sopravvivenza era sovrapponibile a quella della popolazione generale.
Dunque l’UDCA aumenta la sopravvivenza, ma nel 2006 Albert Pares si pone una domanda cruciale Quali sono i pazienti che beneficiano maggiormente dell’UDCA? e identifica nei soggetti con calo di APh >40% una categoria che, non solo aveva una prognosi nettamente migliore, ma otteneva anche una sopravvivenza molto vicina a quella della popolazione generale (4). Questo lavoro ha dato la stura all’elaborazione di criteri di risposta, che derivano il nome dalle sedi in cui sono stati elaborati (Barcellona - Parigi I e II - Mayo - Rotterdam - Toronto - Globe Score - UK-PBC score).
Attualmente viene assunto come criterio di risposta internazionale il raggiungimento di valori di APh < 1,5 x ULN dopo un anno di terapia con UDCA. È intuitivo che non tutti i pazienti in UDCA raggiungono questo obiettivo, con tassi di successo superiori nei centri di riferimento secondari (80%), inferiori (61%) nei centri terziari (5).
Se fino al 2016 definire risposta/non risposta all’UDCA rappresentava solo un esercizio prognostico, che si traduceva al più in un pragmatico aumento di dosaggio dall’UDCA, dal 2016 i non responder (NR) possono fruire di trattamenti di seconda linea.
Tre farmaci si candidano come trattamento di seconda linea, uno - l’acido obeticolico (OCA) – registrato per il trattamento della CBP NR ad UDCA, due off label (bezafibrato e budesonide).
L’OCA è un acido biliare sintetico agonista di FXR (Farnesoid X Receptor). L’FXR ha un ruolo strategico nel trafficking degli acidi biliari in quanto ne inibisce sintesi, uptake e ne aumenta l’escrezione sul polo biliare dell’epatocita. La sua azione è in gran parte mediata attraverso il recettore PPARα su cui il bezafibrato svolge un’azione agonista e il glucocorticoid receptor su cui l’azione agonista è svolta dagli steroidi.
Nello studio di registrazione i pazienti trattati con OCA + UDCA ottenevano una significativa e rapida riduzione dei livelli di APh. Al termine dei 12 mesi di terapia, 48% dei soggetti trattati con OCA 10 mg e 46% dei soggetti trattato con OCA titolato a 5-10 mg in relazione a risposta, avevano raggiunto l’endpoint primario (APh <1,67 x ULN, bilirubina 15%) vs 10% placebo.
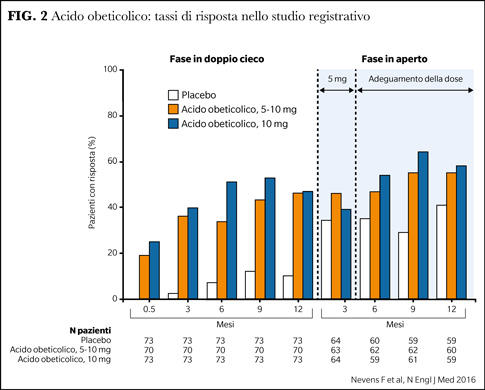 L’OCA non è scevro da effetti collaterali, il più frequente è il prurito (fino al 72% dei trattati vs 38% placebo), che spesso tende a scemare con il prosieguo della terapia (6) (Figura 2). Particolare attenzione occorre nei pazienti con cirrosi avanzata, dove OCA è risultato talora associato a insufficienza epatica (7).
L’OCA non è scevro da effetti collaterali, il più frequente è il prurito (fino al 72% dei trattati vs 38% placebo), che spesso tende a scemare con il prosieguo della terapia (6) (Figura 2). Particolare attenzione occorre nei pazienti con cirrosi avanzata, dove OCA è risultato talora associato a insufficienza epatica (7).
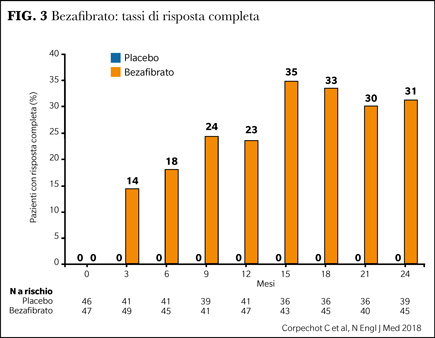
I fibrati – dimostratisi efficaci nel ridurre la colestasi CBP-relata in studi prevalentemente orientali – hanno scoperto una nuova giovinezza quando nel 2018 Corpechot pubblica un RCT in cui 99 pazienti sono stati assegnati a bezafibrato 400 mg 1 co/die o placebo per 24 mesi, ottenendo una percentuale di risposta – espressa come APh <1,5 x ULN – che raggiunge il 35% nei soggetti trattati (vs 0% placebo). La liver stiffness – valutata a 12 e 24 mesi – si è ridotta significativamente nel gruppo trattato. Ancillarmente il bezafibrato era capace di condurre a remissione l’eventuale prurito (8) (Figura 3).
 Infine la budesonide, che – come in precedenza altre formulazioni di steroidi – non ha pienamente confermato le attese teoriche, non avendo raggiunto gli ambiziosi endpoint istologici, sebbene il 35% dei pazienti ha ottenuto la normalizzazione dei livelli di APh (9).
Infine la budesonide, che – come in precedenza altre formulazioni di steroidi – non ha pienamente confermato le attese teoriche, non avendo raggiunto gli ambiziosi endpoint istologici, sebbene il 35% dei pazienti ha ottenuto la normalizzazione dei livelli di APh (9).
Nonostante OCA e bezafibrato condividano le stesse vie di signaling, la combinazione dei due farmaci in 50 NR a UDCA, ha condotto ad un significativo aumento dei tassi di normalizzazione di APh. Un approccio di questo tipo rappresenta non solo una terza linea di terapia, ma risulta strategico nei pazienti NR con prurito, dove l’aggiunta in prima istanza di fibrati può garantirne controllo e – a prurito controllato – l’aggiunta di OCA può contribuire al successo (10).
Numerosi nuovi farmaci – acidi biliari sintetici, agonisti di FXR e PPARα, antifibrotici – sono nella pipeline di sviluppo e trial, ma soprattutto a breve saranno disponibili i dati di OCA vs sopravvivenza, questo ci consentirà di capire se OCA – al di là dell’effetto biochimico – impatta sulla sopravvivenza e se i marcatori di risposta sviluppati con UDCA mantengono il loro potere predittivo di sopravvivenza anche con OCA e fibrati.
- Boonstra K, Beuers U, Ponsioen CY. Epidemiology of primary biliary cholangitis and primary biliary cirrhosis: a systematic review. J Hepatol. 2012; 56:1181-88.
- Marzioni M, Bassanelli C, Ripellino C, et al. Epidemiology of primary biliary cholangitis in Italy: evidence form a real-world database. Dig Liver Dis. 2019; 51:724-29.
- Hirschfield G, Beuers U, Corpechot C, et al. EASL Clinical Practice Guidelines: the diagnosis and management of patients with primary biliary cholangitis. J Hepatol. 2017; 67:145-72.
- Pares A, Caballeria L, Rodes J. Excellent long-term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic acid. Gastroenterology. 2006; 130:715-20.
- Carbone M, Sharp SJ, Flack S, et al. The UK-PBC risk scores: derivation and validation of a scoring system for long-term prediction of end-stage liver disease in primary biliary cholangitis. Hepatology. 2016; 63:930-50.
- Nevens F, Andreone P, Mazzella G, et al. A placebo-controlled trial of obeticholic acid in primary biliary cholangitis. N Engl J Med. 2016; 375:631-43.
- D’Amato D, De Vicentis A, Malinverno F, et al. Real-world experience with obeticholic acid in patients with primary biliary cholangitis. JHEP Rep. 2021 Jan 27; 3(2):100248.
- Corpechot C, Chazouillières O, Rousseau A, et al. A placebo-controlled trial of bezafibrate in primary biliary cholangitis. N Engl J Med. 2018; 378:2171-81.
- Hirschfield GM, Beuers U, Kupcinskas L, et al. A placebo-controlled randomised trial of budesonide for PBC following an insufficient response to UDCA. J Hepatol. 2021; 74:321-29.
- Soret PA, Lam L, Carrat F, et al. Combination of fibrates and obeticholic acid is able to normalise biochemical liver tests in patients with difficult to treat primary biliary cholangitis. Aliment Pharmacol Ther. 2021; 53:1138-46.







