L’epidemiologia dell’infezioni sostenute da batteri multiresistenti Gram-negativi sta subendo una rapida evoluzione in Italia e nel resto d’Europa (1). L’antimicrobicoterapia, dall’altra parte, cerca di seguire (o inseguire) questo fenomeno mettendoci a disposizione sempre nuove molecole antibiotiche che siano funzionali nella gestione di infezioni batteriche con limitate opzioni terapeutiche. Attualmente la maggior parte dei nuovi antibiotici con attività verso Gram-negativi multiresistenti derivano da associazioni di molecole antibiotiche pre-esistenti con nuovi inibitori delle β-lattamasi, come nel caso di ceftazidime/avibactam, meropenem/vaborbactam ed imipenem/cilastatina/relebactam (2). Il cefepime, cefalosporina di quarta generazione che grazie alla sua struttura zwitterionica a carica neutrale è in grado di penetrare con rapidità la membrana esterna della maggior parte di batteri Gram-negativi (3), è protagonista anch’esso di un aggiornamento delle proprie caratteristiche farmacologiche e microbiologiche grazie all’associazione con nuovi inibitori delle β-lattamasi.
Nello specifico l’evoluzione del cefepime è passata attraverso la creazione di combinazioni terapeutiche che potessero ampliarne l’attività verso le principali classi di β-lattamasi al momento conosciute come le β-lattamasi a spettro esteso (i.e., ESBL), le carbapenemasi KPC, lemetallo β-lattamasi (i.e., MBL) e le OXA-48. In questo articolo impareremo a conoscere nello specifico le principali caratteristiche ed usi clinici di cefepime/enmetazobactam (C/E), cefepime/taniborbactam (C/T),cefepime/zidebactam (C/Z) ed il recentissimo cefepime/nacubactam (C/N).
Cefepime/enmetazobactam
La prima associazione terapeutica approvata in Europa è quella con enmetazobactam un nuovo inibitore della β-lattamasi ad ampio spettro appartenente alla classe dei sulfoni dell’acido penicillanico, molto simile come struttura a tazobactam (2). Questa associazione è in grado di inibire Enterobacterales e Pseudomonas aeruginosa produttori di β-lattamasi di classe A come CTX-M, TEM, SHV (i.e., ma non KPC), di classe C come le Amp-Ced alcune di classe D come OXA-48. Tuttavia C/E non presenta attività con altri Gram-negativi non fermentanti come Acinetobacter baumannii e Stenotrophomonas maltophilia (2). C/E (2g/0.5g) è stato approvato al dosaggio di 2g/0.5g ogni 8 ore per via endovenosa nel trattamento di infezioni complicate delle vie urinarie (i.e., cUTI) e per polmoniti associate all’ospedalizzazione (i.e., HAP) ed alla ventilazione (i.e., VAP) con o senza batteriemia associata. C/E dal punto di vista clinico è stato studiato in 2 studi di fase I, uno studio di fase II ed uno di fase III (2,4).
Nello specifico lo studio registrativo globale (condotto in 19 paesi e 112 ospedali) multicentrico di fase III denominato ALLIUM ha confrontato 1034 pazienti randomizzati in due gruppi al trattamento con C/E 2g/0,5g ogni 8 ore o piperacillina/tazobactam 4g/0,5g ogni 8 ore (516 vs 518 pazienti, rispettivamente) (4). Lo studio ALLIUM h a r aggiunto i c riteri p er l a n on-inferiorità e la superiorità di C/E rispetto a piperacillina/tazobactam nelle cUTI con un successo di trattamento del 79% (n=273) rispetto al 59% (n=196) dei casi nella popolazione microbiological modified intention-to-treat (m-MITT) (4). La non-inferiorità e la superiorità è stata confermata anche nella cura clinica di C/E rispetto a piperacillina/tazobactam (92% vs. 89%). Nonostante un ottimo profilo di sicurezza nel gruppo C/E rispetto al comparatore, è stata notato un maggior numero di casi di infezione da Clostridioides difficile (13% vs. 0%) (4).
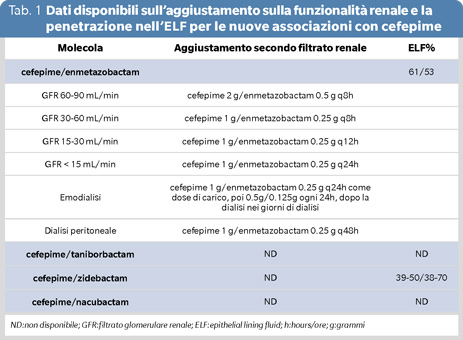 In prospettiva per l’utilizzo di C/E nell’ambito di HAP e VAP, sono meritevoli di essere riportati i dati di Das e coll. che hanno valutato questa nuova associazione di cefepime con enmetazobactam dal punto di vista farmacocinetico in un trial clinico per valutarne la penetrazione nell’epithelial lining fluid (ELF) (5). Lo studio è stato condotto su volontari sani al dosaggio di 2g/1g ogni 8 ore ed ha dimostrato una simile diffusione polmonare delle due molecole con una ratio ra l’area under the curve (AUC)(0–24) su plasma e AUC(0–24) sull’ELF del 61% (± 29) per cefepime e del 53% (±21) per enmetazobactam (5). Entrambi i composti della combinazione sono escreti principalmente per via renale e necessitano di una riduzione del dosaggio in caso di insufficienza renale come riportato in tabella 1.
In prospettiva per l’utilizzo di C/E nell’ambito di HAP e VAP, sono meritevoli di essere riportati i dati di Das e coll. che hanno valutato questa nuova associazione di cefepime con enmetazobactam dal punto di vista farmacocinetico in un trial clinico per valutarne la penetrazione nell’epithelial lining fluid (ELF) (5). Lo studio è stato condotto su volontari sani al dosaggio di 2g/1g ogni 8 ore ed ha dimostrato una simile diffusione polmonare delle due molecole con una ratio ra l’area under the curve (AUC)(0–24) su plasma e AUC(0–24) sull’ELF del 61% (± 29) per cefepime e del 53% (±21) per enmetazobactam (5). Entrambi i composti della combinazione sono escreti principalmente per via renale e necessitano di una riduzione del dosaggio in caso di insufficienza renale come riportato in tabella 1.
Cefepime/taniborbactam
Taniborbactam è il secondo inibitore delle lattamasi associato a cefepime ed è di derivazione boronica: è in grado di agire come inibitore irreversibile delle serine β-lattamasi ed inibitore competitivo delle MBL (2). L’associazione C/T presenta un ampio spettro sulle β-lattamasi includendo tutte le quattro classi di Ambler (i.e., A, B, C e D), mantenendo una buona attività microbiologica sulle principali Enterobacterales, e su Gram-negativi non fermentanti come P. aeruginosa, S. maltophilia (ma non A. baumannii) (2). Seppur l’attività di C/T sia notevole su tutte le MBL, sono riportati ceppi di E. coli produttori di NDM (New Delhi Metallo beta-lactamase) con MIC per C/T elevate e per cui il farmaco potrebbe non risultare clinicamente efficace (6).
C/T (2g/0.5g) è stato valutato al dosaggio di 2g/0.5g ogni 8 ore per via endovenosa nel trattamento di infezioni complicate delle vie urinarie (i.e., cUTI) nei confronti di meropenem 1g ogni 8 ore ed è in corso di valutazione dalla Food and Drug Administration (FDA) nel trattamento di cUTI, dopo un primo rifiuto di approvazione (7,8). Nello specifico lo studio registrativo di fase III di Wagenlehner e coll., ha confrontato 661 pazienti randomizzati 2:1 in doppio cieco, nei due gruppi di trattamento. Lo studio ha dimostrato una non-inferiorità e superiorità di C/T rispetto a meropenem nelle cUTI con un successo di trattamento del 70.6% (n=207) rispetto al 58% (n=83) considerando l’endpoint composito primario clinico e microbiologico (7).
Le differenze nella risposta al trattamento di C/T rispetto a meropenem si sono confermate anche nel follow-up tardivo a 28 e 35 giorni. Infine lo studio pubblicato da Wagenlehner e coll. ha rilevato un maggior numero di eventi avversi nel gruppo C/T (35.5% vs. 29.0%) principalmente cefalea, diarrea, stipsi, ipertensione e nausea (7). Entrambi i composti della combinazione sono escreti principalmente per via renale e necessitano di una riduzione del dosaggio in caso di insufficienza renale come riportato in tabella 1.
Cefepime/zidebactam
C/Z deriva dall’associazione di cefepime con un inibitore di derivazione diazobiciclottanica chiamato zidebactam (2). Quest’ultimo presenta una attività antimicrobica intrinseca, non β-lattamica, con una alta affinità per le penicillin binding protein (PBP2) dei Gram-negativi ed una azione di inibizione su un ampio spettro di β-lattamasi nello specifico le classi A, B, C e D di Ambler (2). L’azione antimicrobica di C/Z in vitro è stata riportata per i principali Enterobacterales e nei confronti di Gram-negativi non fermentanti come P. aeruginosa, S. maltophilia ed in misura minore anche su alcuni ceppi di A. baumannii (2). C/Z è in corso di valutazione in uno studio di fase III, multicentrico, randomizzato in doppio cieco, (Clinicaltrial.gov; NCT04979806) al dosaggio di 2g/1g ogni 8 ore in confronto con meropenem 1g ogni 8 ore nel trattamento dei pazienti ospedalizzati per cUTI (9). Lo studio attualmente risulta ancora in corso ma prevede la raccolta di almeno 528 pazienti con età superiore ai 18 anni con cUTI confermata ed il trattamento assegnato in doppio cieco con C/Z o meropenem verrà somministrato tra i 7 ed i 10 giorni (9).
Recentemente sono state pubblicate alcune esperienze in forma di case report in cui C/Z è stato utilizzato nel trattamento di P. aeruginosa XDR, nello specifico in ceppi MBL produttori di NDM ad uso compassionevole con risultati promettenti (10-11).
In letteratura sono disponibili anche dati di farmacocinetica per la penetrazione di C/Z nell’ELF in volontari sani (12). I dati disponibili riportano una ratio tra l’AUC(0–24) su plasma e AUC(0–24) sull’ELF del 39% per cefepime e del 38% per zidebactam (12). In altri studi successivi la penetrazione di cefepime e di zidebactam è stata riscontrata più elevata, con valori che arrivano rispettivamente al 50 e 70% (13). Entrambi i composti della combinazione sono escreti principalmente per via renale e necessitano di una riduzione del dosaggio in caso di insufficienza renale come riportato in tabella 1.
Cefepime/nacubactam
Nacubactam, come zidebactam, è un inibitore delle β-lattamasi di derivazione diazobiciclottanica in corso di studio in associazione a cefepime. Nacubactam presenta potenzialmente una attività su tutte le classi di β-lattamasi (A, B, C e D) e la sua attività clinica risulta in corso di studio nel trattamento delle cUTI insieme ad una altra nuova combinazione di nacubactam con aztreonam in confronto ad imipenem/cilastatina nello studio multicentrico, randomizzato di fase III denominato Integral-1.
I dati di questo studio di fase III non risultano al momento ancora disponibili. Il gruppo di Igarashi e coll., ha riportato i primi dati di farmacocinetica e farmacodinamica per C/N rilevando sperimentalmente come il profilo farmacocinetico del farmaco sia più prevedibile con un modello diT>MIC (14).
Yanagihara e coll. hanno recentemente pubblicato uno studio retrospettivo con lo scopo di testare C/N su isolati prelevati da ospedali giapponesi su ceppi di Enterobacterales produttori di carbapenemasi (n=184) e di ceppi non produttori di carbapenemasi (n=192) (15). La percentuale di suscettibilità per C/N è stata valutata utilizzando il breakpoint per cefepime proposto dal CLSI. La percentuale di ceppi produttori di carbapenemasi con suscettibilità residua a C/N è risultata essere del 95.7% e del 99.0% nei ceppi non produttori di carbapenemasi (15).
Discussione
L’introduzione nella pratica clinica di queste nuove molecole di associazione amplia l’armamentario terapeutico nel trattamento dell’infezione da Gram-negativi multiresistenti (Figura 1).
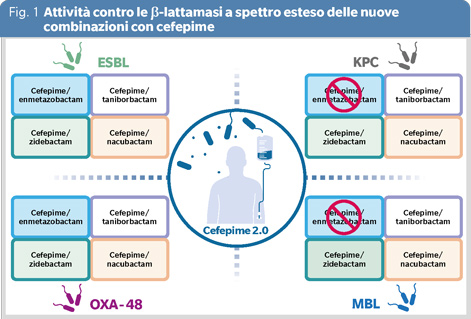 L’aumento delle possibilità terapeutiche in ambito infettivologico pone però questioni di appropriatezza terapeutica, crea opportunità di stewardship antimicrobica e di personalizzazione della terapia antibiotica. I progetti attuati in molte realtà infettivologiche, inseriti nei progetti di stewardship antimicrobica, di risparmio di molecole come i carbapenemi (i.e., il cosiddetto carbapenem sparing) o di riduzione di terapie di associazione, empiriche e mirate, sono due delle opportunità di appropriatezza terapeutica e di stewardship che il clinico ha il compito di prendere in considerazione in vista dell’ampliamento delle scelte terapeutiche nella gestione delle infezioni da Gram-negativi. Le molecole derivate da associazioni con cefepime possono ricoprire un ruolo importante in queste scelte come alternative a molecole di nuova introduzione con associazione di carbapenemi come meropenem/vaborbactam ed imipenem/cilastatina/relebactam, soprattutto nel trattamento di cUTI e di infezioni respiratorie con o senza batteriemia associata. Le opportunità di carbapenem-sparing possono essere anche osservate in prospettiva nel trattamento di infezioni da ESBL e da AmpC dato lo spettro favorevole per tutte le molecole che abbiamo descritto contro questi ceppi. Le associazioni descritte in questo articolo, soprattutto nelle monoterapie ed in terapia empirica, possono comunque riportare delle insidie in alcuni distretti anatomici come le infezioni intra-addominali rispetto ai comparatori precedentemente citati (i.e. meropenem/vaborbactam ed imipenem/cilastatina/relebactam), questo per l’assenza di copertura su microorganismi anaerobi e nel limitato spettro su Gram-positivi come gli Enterococchi, frequentemente isolati in questi distretti.
L’aumento delle possibilità terapeutiche in ambito infettivologico pone però questioni di appropriatezza terapeutica, crea opportunità di stewardship antimicrobica e di personalizzazione della terapia antibiotica. I progetti attuati in molte realtà infettivologiche, inseriti nei progetti di stewardship antimicrobica, di risparmio di molecole come i carbapenemi (i.e., il cosiddetto carbapenem sparing) o di riduzione di terapie di associazione, empiriche e mirate, sono due delle opportunità di appropriatezza terapeutica e di stewardship che il clinico ha il compito di prendere in considerazione in vista dell’ampliamento delle scelte terapeutiche nella gestione delle infezioni da Gram-negativi. Le molecole derivate da associazioni con cefepime possono ricoprire un ruolo importante in queste scelte come alternative a molecole di nuova introduzione con associazione di carbapenemi come meropenem/vaborbactam ed imipenem/cilastatina/relebactam, soprattutto nel trattamento di cUTI e di infezioni respiratorie con o senza batteriemia associata. Le opportunità di carbapenem-sparing possono essere anche osservate in prospettiva nel trattamento di infezioni da ESBL e da AmpC dato lo spettro favorevole per tutte le molecole che abbiamo descritto contro questi ceppi. Le associazioni descritte in questo articolo, soprattutto nelle monoterapie ed in terapia empirica, possono comunque riportare delle insidie in alcuni distretti anatomici come le infezioni intra-addominali rispetto ai comparatori precedentemente citati (i.e. meropenem/vaborbactam ed imipenem/cilastatina/relebactam), questo per l’assenza di copertura su microorganismi anaerobi e nel limitato spettro su Gram-positivi come gli Enterococchi, frequentemente isolati in questi distretti.
Seppur il profilo di sicurezza di queste molecole di associazione con cefepime risulti interessante, può allo stesso tempo nascondere delle insidie soprattutto per il rischio di effetti collaterali come la neurotossicità, comune anche nelle monoterapie con cefepime con quadri di encefalopatia iatrogena soprattutto in anziani, pazienti con insufficienza renale e pregresse patologie neurologiche. Inoltre, come presentato precedentemente, è da tenere in considerazione il possibile rischio di infezioni correlate all’assistenza come le coliti da Clostridioides difficile che appaiono più frequenti secondo dati preliminari per alcune molecole come ad esempio C/E.
L’ingresso in commercio di queste combinazioni terapeutiche risulta promettente anche in alcuni campi di difficile gestione dal punto di vista microbiologico per il consulente infettivologo, come le infezioni da MBL e da OXA-48 in cui zidebactam, taniborbactam e nacubactam potranno diventare alternative interessanti nei prossimi anni soprattutto in ambito di cUTI e nelle infezioni respiratorie. Sarà interessante inoltre comprendere gli sviluppi della farmacologia nel therapeutic drug monitoring di queste nuove associazioni, soprattutto in vista di una personalizzazione della terapia antibioca, date le difficoltà in molti centri nella disponibilità di dosaggi puntuali di cefepime. L’aggiornamento di cefepime ed il suo nuovo ruolo in associazione nelle infezioni da Gram-negativi multiresistenti dà un nuovo respiro alla terapia antimicrobica, ma pone questioni importanti di risparmio ed appropriatezza delle molecole alla ricerca sempre più di un approccio tailor-made nelle infezioni da patogeni difficili da trattare.
- European Antimicrobial Resistance Collaborators. The burden of bacterial antimicrobial resistance in the WHO European region in 2019: a crosscountry. systematic analysis. Lancet Public Health. 2022;7(11):e897-e913.
- Principe L, Lupia T, Andriani L, et al. Microbiological, Clinical, and PK/PD Features of the New Anti-Gram-Negative Antibiotics: β-Lactam/β-Lactamase Inhibitors in Combination and Cefiderocol-An All-Inclusive Guide for Clinicians. Pharmaceuticals (Basel). 2022;15(4):463.
- Pais GM, Chang J, Barreto EF, et al. Clinical Pharmacokinetics and Pharmacodynamics of Cefepime. Clin Pharmacokinet. 2022 Jul;61(7):929-953.
- Kaye KS, Belley A, Barth P, et al. Effect of Cefepime/Enmetazobactam vs Piperacillin/Tazobactam on Clinical Cure and Microbiological Eradication in Patients With Complicated Urinary Tract Infection or Acute Pyelonephritis: A Randomized Clinical Trial. JAMA. 2022;328(13):1304-1314.
- Das S, Fitzgerald R, Ullah A, et al. Intrapulmonary Pharmacokinetics of Cefepime and Enmetazobactam in Healthy Volunteers: Towards New Treatments for Nosocomial Pneumonia. Antimicrob Agents Chemother. 2020;65(1):e01468-20.
- Ferous S, Anastassopoulou C, Pitiriga V, et al. Antimicrobial and Diagnostic Stewardship of the Novel β-Lactam/β-Lactamase Inhibitors for Infections Due to Carbapenem-Resistant Enterobacterales Species and Pseudomonas aeruginosa. Antibiotics (Basel). 2024;13(3):285.
- Wagenlehner FM, Gasink LB, McGovern PC, et al. Cefepime-Taniborbactam in Complicated Urinary Tract Infection. N Engl J Med. 2024;390(7):611-622.
- https://www.cidrap.umn.edu/antimicrobial-stewardship/fda-rejects-new-drug-application-cefepime-taniborbactam
- https://classic.clinicaltrials.gov/ct2/show/NCT04979806
- Dubey D, Roy M, Shah TH, et al. Compassionate use of a novel β-lactam enhancer-based investigational antibiotic cefepime/zidebactam (WCK 5222) for the treatment of extensively-drug-resistant NDM-expressing Pseudomonas aeruginosa infection in an intra-abdominal infection-induced sepsis patient: a case report. Ann Clin Microbiol Antimicrob. 2023;22(1):55.
- Tirlangi PK, Wanve BS, Dubbudu RR, et al. Successful Use of Cefepime-Zidebactam (WCK 5222) as a Salvage Therapy for the Treatment of Disseminated Extensively Drug-Resistant New Delhi Metallo-β-Lactamase-Producing Pseudomonas aeruginosa Infection in an Adult Patient with Acute T-Cell Leukemia. Antimicrob Agents Chemother. 2023;67(8):e0050023.
- Abdelraouf K, Almarzoky Abuhussain S, Nicolau DP. In vivo pharmacodynamics of new-generation β-lactamase inhibitor taniborbactam (formerly VNRX-5133) in combination with cefepime against serine-β-lactamase-producing Gram-negative bacteria. J Antimicrob Chemother. 2020;75(12):3601-3610.
- Abdelraouf K, Nicolau DP. In vivo pharmacokinetic/pharmacodynamic evaluation of cefepime/taniborbactam combination against cefepime-nonsusceptible Enterobacterales and Pseudomonas aeruginosa in a murine pneumonia model. J Antimicrob Chemother. 2023 Mar 2;78(3):692-702.
- Igarashi Y, Takemura W, Liu X, et al. In vivo Pharmacokinetic/Pharmacodynamic Analysis of the Efficacy of the Cefepime/Nacubactam Combination Against β-Lactamase-Producing Enterobacterales based on the Instantaneous MIC Concept. Pharm Res. 2023;40(10):2423-2431.
- Yanagihara K, Mikamo H, Tateda K, et al. 2136. In Vitro Activity of Nacubactam (OP0595) Combined with Cefepime against Carbapenem-resistant Enterobacterales Isolated in Japan. Open Forum Infectious Diseases. 2023;10(Suppl 2), ofad500.1759.







