Candida auris è un lievito emergente che nel 2019 è stato nominato nel report del CDC tra i cinque patogeni elencati come minacce urgenti per la salute pubblica a causa di un aumento dei tassi di morbilità e mortalità negli Stati Uniti (https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf).
La caratteristica che differenzia C. auris da altre specie di Candida consiste nella sua capacità unica di diffondersi tra i pazienti attraverso il contatto con superfici contaminate all'interno dei sistemi sanitari, con riportati tassi di mortalità in caso di infezioni invasive tra 30% e 60%, anche se il tasso di mortalità attribuibile è difficile da determinare a causa delle condizioni cliniche dei pazienti, con la presenza di comorbilità importanti.
Origini della nuova specie emergente
L’identificazione di C. auris è stata riportata per la prima volta nel 2009 nell’isolamento ottenuto dal campione raccolto nel 2006 dall’orecchio esterno (da lì il nome auris) di un paziente giapponese e facente parte di uno studio sui lieviti (1).
Il sequenziamento ha rivelato che l'isolato era strettamente correlato a Candida haemulonii (possibile errata identificazione da parte di VITEK 2), C. pseudohaemulonii, C. ruelliae e C. heveicola, ma aveva caratteristiche diverse, tra le quali la capacità di crescere a 42°C (1). A causa di una possibile mis-identificazione della specie nuova, diversi studi hanno cercato la presenza di questa specie nelle loro collezioni storiche dei ceppi, con il primo ceppo identificato nel campione di emocoltura sudcoreano del 1996 (1).
Una delle domande interessanti sull’emergenza di C. auris è stabilire se si è trattato di un evento singolo successivamente diffuso globalmente o ci sono stati plurimi episodi di emergenza in diverse parti del mondo (2). Gli studi di sequenziamento del genoma hanno identificato inizialmente quattro diversi gruppi (clades) filogenetici con distribuzione geografica specifica: Clade I sudasiatico; Clade II asiatico orientale; Clade III sudafricano; Clade IV sudamericano, e successivamente Clade V iraniano. è stato documentato che nel Regno Unito e negli Stati Uniti si sono verificati molteplici eventi di introduzione di C. auris, seguiti da trasmissione locale, documentando progressiva sovrapposizione di presenza di clades diversi. L’impatto clinico di conoscere i clade che circolano localmente deriva dal fatto che vi sono dalle differenze importanti nella sensibilità agli antifungini e nella virulenza tra clade diversi.
Caratteristiche particolari
Tra le più importanti caratteristiche di C. auris vi è un'elevata trasmissibilità grazie alla sua capacità di causare una colonizzazione molto prolungata (potenzialmente life-long) dei pazienti e di resistere nell'ambiente sanitario, sopravvivendo a lungo sulle superfici inanimate, producendo biofilm e resistendo ai comuni disinfettanti (3).
In secondo luogo, è presente un tasso alto di resistenza agli antimicotici: quasi universale a fluconazolo (circa 90%) in alcuni clade, frequente ad amfotericina B (AmB) (30%) e, nel numero molto meno elevato ma significativamente più alto rispetto alle altre specie, alle echinocandine (5%), con la capacità di sviluppare resistenza alle echinocandine durante il trattamento.
Inizialmente sono state riportate difficoltà nell'identificazione corretta con le tecniche convenzionali, che, fortunatamente, possono essere superate con dei sistemi sempre più disponibili come MALDI-TOF e sequenziamento. Infatti, se non disponibili, gli isolati delle infezioni invasive di specie potenzialmente mis-identificate dovrebbero essere inviati presso un laboratorio di riferimento.
Infine, C. auris ha un potenziale senza precedenti di causare focolai nosocomiali, che possono essere difficili da controllare: sono stati frequentemente riportati durante la pandemia COVID-19, grazie all’elevata trasmissibilità, numerosi serbatoi ambientali nell’ambito nosocomiale (difficili da individuare e bonificare), ed estesa colonizzazione documentata nei pazienti a livello ascellare, inguinale, nasale e rettale (4,5).
Mentre inizialmente i CDC segnalavano tutti i paesi dove avveniva l’isolamento di C. auris, tale mappa non viene più aggiornata a partire dal 15 febbraio 2021, in quanto la diffusione si è propagata ulteriormente comprendendo 46 paesi (https://www.cdc.gov/fungal/candida-auris/tracking-c-auris.html).
Resistenza agli antifungini
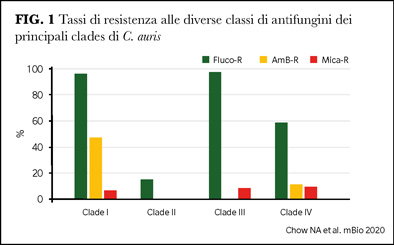 La resistenza agli antifungini è il principale problema clinico in quanto fino al 40% degli isolati di C. auris possono essere resistenti ad almeno due classi di antifungini contemporaneamente, limitando le opzioni terapeutiche.
La resistenza agli antifungini è il principale problema clinico in quanto fino al 40% degli isolati di C. auris possono essere resistenti ad almeno due classi di antifungini contemporaneamente, limitando le opzioni terapeutiche.
Sono state riportate le differenze nei profili di resistenza di clades diversi (Figura 1), con il profilo peggiore per il Clade I (che risulta al momento anche prevalente negli Stati Uniti ed Europa) per il quale nel 4% è stata registrata la resistenza a tutte tre le classi degli antifungini (2). Infatti, oltre l'80% e circa il 30% dei ceppi appartenenti al Clade I sono resistenti a fluconazolo e ad AmB, rispettivamente, rendendo il trattamento molto difficile in caso di sviluppo di resistenza anche alle echinocandine.
Inoltre, la scelta della terapia in casi di valori di MIC elevate è ulteriormente complicata dalla mancanza di breakpoint clinici per la definizione di sensibilità. Solo nel maggio 2020, i CDC hanno pubblicato breakpoint provvisori per C. auris (valutati con il metodo Clinical Laboratory Standards Institute, CLSI).
Il breakpoint per fluconazolo è stato stabilito come MIC 32 μg/mL o superiore, con numerosi isolati con MIC molto elevate. I ceppi con MIC≥32 μg/mL avevano mutazioni di resistenza nel gene Erg11, rendendo poco probabile la possibilità alla risposta a fluconazolo. Non sono disponibili breakpoint per gli altri azoli e si raccomanda di utilizzare la sensibilità a fluconazolo come surrogato per la valutazione della sensibilità ai triazoli di seconda generazione, sebbene gli isolati resistenti a fluconazolo possano rispondere occasionalmente al trattamento con gli altri azoli. Per AmB, gli isolati con MIC≥2 μg/mL sono considerati resistenti. Per le echinocandine i breakpoint sono 4 μg/mL per anidulafungina e micafungina e 2 μg/mL per caspofungina.
Alcuni studi hanno riportato diversi tassi di resistenza per le tre echinocandine, solitamente i più elevati per caspofungina, anche se l’impatto clinico di questa osservazione rimane da confermare.
Recentemente alcuni autori hanno valutato la concordanza di diversi metodi di saggio di sensibilità ed hanno riportato i tassi di resistenza ai triazoli utilizzando cut-off epidemiologici per C. glabrata secondo metodo CLSI per voriconazolo (0.25 μg/mL) e riportando valori inferiori in tutti i ceppi testati.
Infezioni invasive
 Nei pazienti colonizzati, il tasso di infezione invasiva è di circa il 15%, e dipende da numerosi fattori, alcuni dei quali simili a quelli riportati per le candidemie causate da altre specie, con rilevante impatto dell'esposizione nosocomiale e del precedente utilizzo di antifungini. Andrebbe sottolineato che nei pazienti colonizzati il tasso di infezioni invasive dipenderà anche dalla durata di colonizzazione e dalle complicanze sviluppate durante il ricovero ospedaliero. Infatti, l’incidenza potrebbe essere anche superiore al 25% nei pazienti che rimangono in terapia intensiva per un tempo prolungato (6).
Nei pazienti colonizzati, il tasso di infezione invasiva è di circa il 15%, e dipende da numerosi fattori, alcuni dei quali simili a quelli riportati per le candidemie causate da altre specie, con rilevante impatto dell'esposizione nosocomiale e del precedente utilizzo di antifungini. Andrebbe sottolineato che nei pazienti colonizzati il tasso di infezioni invasive dipenderà anche dalla durata di colonizzazione e dalle complicanze sviluppate durante il ricovero ospedaliero. Infatti, l’incidenza potrebbe essere anche superiore al 25% nei pazienti che rimangono in terapia intensiva per un tempo prolungato (6).
Tra i fattori di rischio per l’infezione invasiva sono stati riportati la nutrizione parenterale, la presenza del catetere venoso centrale, un precedente intervento chirurgico, un precedente trattamento antifungino e la colonizzazione di almeno due siti (6).
Sebbene sia stata riportata un'elevata mortalità globale in alcuni contesti, oltre il 70% in uno studio indiano, il tasso mediano di mortalità in una meta-analisi sistematica è stato del 39% (7). L’aspetto positivo è che diversi studi hanno dimostrato la mortalità simile nei pazienti con candidemia da C. auris e con quelle causate dalle altre specie (8).
Trattamento
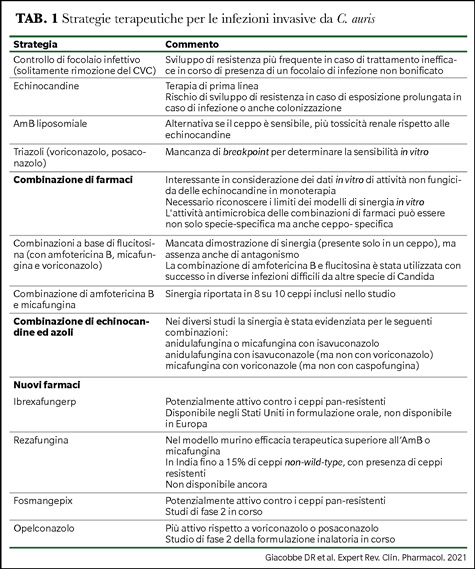
Il trattamento di prima linea di infezioni invasive da C. auris si basa sull’utilizzo di echinocandine, e in considerazione del rischio di emergenza di ceppi pan-resistenti, un adeguato e tempestivo source control è fondamentale (9). Nei casi difficili di infezione persistente o riscontro di resistenza alle echinocandine, sono necessarie strategie terapeutiche più complicate (Tabella 1).
Infectioncontrol
Poiché il controllo di grandi focolai è estremamente impegnativo, limitare immediatamente la diffusione rimane una misura preventiva fondamentale. Pertanto, un rilevamento di C. auris dovrebbe essere tempestivamente segnalato al dipartimento di controllo delle infezioni, portando all'attuazione immediata di rigorose misure di prevenzione e controllo delle infezioni secondo le raccomandazioni internazionali (10).
- Forsberg K, Woodworth K, Walters M, et al. Candida auris: The recent emergence of a multidrug-resistant fungal pathogen. Med Mycol 2019; 57(1): 1-12.
- Chow NA, Muñoz JF, Gade L, et al. Tracing the Evolutionary History and Global Expansion of Candida auris Using Population Genomic Analyses. mBio 2020; 11(2).
- Desoubeaux G, Coste AT, Imbert C, Hennequin C. Overview about Candida auris: What's up 12 years after its first description? J Mycol Med 2022; 32(2): 101248.
- Eyre DW, Sheppard AE, Madder H, et al. A Candida auris Outbreak and Its Control in an Intensive Care Setting. N Engl J Med 2018; 379(14): 1322-31.
- Rossow J, Ostrowsky B, Adams E, et al. Factors Associated With Candida auris Colonization and Transmission in Skilled Nursing Facilities With Ventilator Units, New York, 2016-2018. Clin Infect Dis 2021; 72(11): e753-e60.
- Briano F, Magnasco L, Sepulcri C, et al. Candida auris Candidemia in Critically Ill, Colonized Patients: Cumulative Incidence and Risk Factors. Infect Dis Ther 2022; 11(3): 1149-60.
- Chen J, Tian S, Han X, et al. Is the superbug fungus really so scary? A systematic review and meta-analysis of global epidemiology and mortality of Candida auris. BMC Infect Dis 2020; 20(1): 827.
- Simon SP, Li R, Silver M, et al. Comparative Outcomes of Candida auris Bloodstream Infections: A Multicenter Retrospective Case-control Study. Clin Infect Dis 2022.
- Giacobbe DR, Magnasco L, Sepulcri C, et al. Recent advances and future perspectives in the pharmacological treatment of Candida auris infections. Expert Rev Clin Pharmacol 2021; 14(10): 1205-20.
- Kenters N, Kiernan M, Chowdhary A, et al. Control of Candida auris in healthcare institutions: Outcome of an International Society for Antimicrobial Chemotherapy expert meeting. Int J Antimicrob Agents 2019; 54(4): 400-6.







