|
| |
| Il paziente a rischio di comorbidità ossea |
|
|
| |
| Individuare i pazienti a rischio elevato |
|
Il primo obiettivo di questo screening è, senza alcun dubbio, quello di individuare quei pazienti che sono a rischio elevato di comorbidità ossea.
A) A tal fine, il primo step deve essere sempre quello di individuare l’eventuale presenza di fattori di rischio, iniziando con l’indagare i fattori di rischio classici per osteoporosi: ipogonadismo, ipertiroidismo, familiarità per fratture di femore, indice di massa corporea < 19 kg/m2, ipovitaminosi D, fumo, sedentarietà/immobilizzazione protratta, pregresse fratture da trauma minimo, età avanzata, razza caucasica, sesso femminile, menopausa e/o amenorrea, assunzione abitudinaria di > tre bicchieri/die di alcol, utilizzo di steroidi (5 mg/die prednisone equivalenti) per via sistemica per > tre mesi.
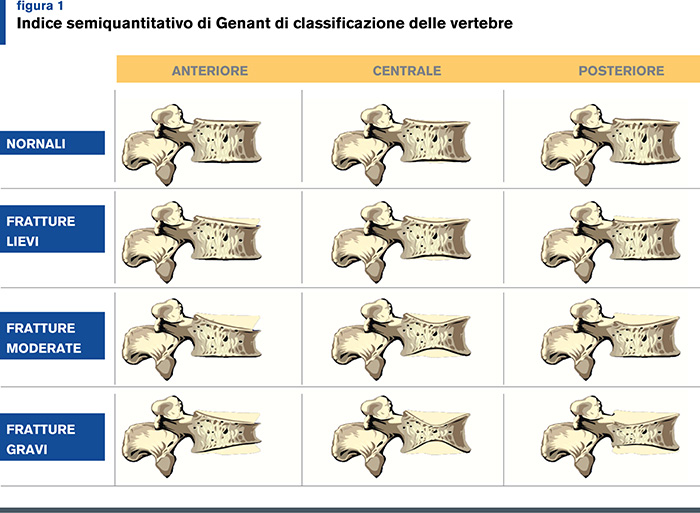
Un altro aspetto che non costa nulla in termini di denaro, e poco in termini di tempo, è la verifica periodica dell’altezza del paziente: un calo staturale di oltre 3 cm rispetto a quanto rilevato a 20-30 anni d’età pone il sospetto diagnostico di frattura vertebrale; in questi casi è opportuno considerare l’esecuzione di un Rx morfometrico del rachide dorsale in proiezione laterale (Figura 1). |
| |
 |
| |
In virtù dell’elevata prevalenza d’ipovitaminosi D in tutta la popolazione italiana, è consigliabile (se possibile) dosare in tutti i pazienti i livelli plasmatici della 25-OH vitamina D, preferenzialmente in inverno e in primavera, per valutare la posologia ottimale di colecalciferolo ai fini di un’efficace supplementazione, come più avanti specificheremo.
Inoltre, poiché in alcuni casi (specie nei soggetti con livelli di 25-OH vitamina D molto bassi) la comune supplementazione standard può non essere in grado di far raggiungere livelli plasmatici ottimali, è indicato riverificare questi ultimi dopo sei mesi dall’inizio della supplementazione.
Collegato spesso all’ipovitaminosi D, l’iperparatiroidismo secondario è una condizione di frequente riscontro nei pazienti con infezione da HIV e determina un aumento del turn-over osseo: per questo motivo è utile la determinazione del paratormone associata al dosaggio della 25-OH vitamina D.
Infine, per completare il processo di individuazione dell’eventuale presenza dei fattori di rischio, una valutazione completa dovrebbe sempre comprendere lo studio degli indici del metabolismo minerale, per escludere e intervenire sulle altre forme di osteoporosi secondaria eventualmente presenti, non correlate in alcun modo all’infezione da HIV e/o alla terapia antiretrovirale in corso.
B) Il secondo step, ai fini di individuare i pazienti a rischio elevato di comorbidità ossea, è quello della stima del loro rischio fratturativo.
Relativamente ai pazienti di età > 40 anni è indicato stimare il rischio di frattura a 10 anni utilizzando l’algoritmo FRAX® (www.shef.ac.uk/FRAX).
Occorre tenere ben presente, però, che l’algoritmo può sottostimare il rischio nei soggetti con infezione da HIV e, nella compilazione, occorre ricordarsi di inserire sempre l’HIV come causa secondaria di osteoporosi.
L’algoritmo FRAX® può essere utilizzato per la stima del rischio anche senza inserire il dato della densità minerale ossea ottenuto dall’indagine DXA, per quanto in questo caso il risultato risulti senza dubbio inevitabilmente meno preciso.
Poiché l’accesso all’indagine DXA non è sempre possibile o agevole per gran parte delle strutture cliniche, quest’aspetto può essere in parte ovviato dall’esame ecografico del calcagno (QUS calcaneare), poiché ha un valore predittivo del rischio di frattura sovrapponibile (se non addirittura superiore) a quello della DXA.
Inoltre, specialmente nelle donne in menopausa, è in grado di individuare meglio i pazienti da inviare a esame DXA, permettendo in tal modo di ottimizzare l’accesso alla metodica e di ridurre i costi complessivi (Figura 2).
C) Il terzo step, ai fini di individuare i pazienti a rischio elevato di comorbidità ossea, è quello della valutazione individuale della loro vulnerabilità.
Certamente l’indagine DXA resta il golden-standard per lo studio della densità minerale ossea e, insieme, il più importante fattore di rischio indipendente per frattura.
Ove, però, non sia possibile eseguirla in tutti i soggetti, è preferibile scegliere quei pazienti in cui sono presenti, oltre ovviamente all’infezione da HIV, almeno due fattori di rischio maggiori per osteoporosi.
Nella lettura del risultato densitometrico, bisogna avere l’accorgimento di utilizzare lo Z-score per le donne in premenopausa e per gli uomini < 50 anni d’età.
In relazione al momento ottimale per ripetere l’indagine nel follow-up del paziente, è consigliato genericamente ripeterla in media ogni 18-24 mesi, ma è bene puntualizzare come, ai fini di un’ottimizzazione del servizio, sia bene schedularla in base al referto ottenuto.
La DXA restituisce certamente un’informazione molto preziosa, ma che ha il limite di essere un dato in un certo qual modo statico, non dinamico.
Pertanto, può essere utile integrarla con i marcatori di neoformazione e riassorbimento osseo, vale a dire con un’indagine che possa restituire informazioni più precise e veloci sull’entità in tempo reale dell’attività dell’unità di rimodellamento osseo.
Questi ultimi, infatti, possono essere molto utili nel predire il rischio di frattura, integrano il dato densitometrico e, se ripetuti, possono fornire informazioni sulla variazione di attività dell’unità di rimodellamento osseo già dopo soli tre - sei mesi (Figura 3). |
| |
 |
| |
| La gestione del paziente a rischio elevato |
|
Il passaggio successivo, una volta individuati i pazienti a rischio elevato di comorbidità ossea, è quello della corretta gestione del paziente a rischio elevato.
A) A tal fine, il primo step deve essere sempre quello relativo agli interventi, ove possibile, sugli stili di vita che favoriscono l’osteoporosi, vale a dire: attività fisica, assunzione regolare di calcio 1 gr/die con la dieta e vitamina D 800 UI/die, prevenzione del dimagramento (indice di massa corporea < 18.5 kg/m2) e del malassorbimento, sospensione del fumo e dell’eccessivo introito di alcol.
B) Il secondo step, ai fini della corretta gestione del paziente a rischio elevato, è quello dell’utilizzo congruo delle terapie complementari.
Su questo punto, come accennato in precedenza, per prima cosa è necessario correggere sempre l’eventuale ipovitaminosi D ove il valore della 25-OH vitamina D risulti inferiore a 75 nmol/l o a 30 ng/ml.
La correzione dell’ipovitaminosi D deve essere effettuata sempre con colecalciferolo: è argomento aperto quale sia la supplementazione standard ottimale; ove non sia possibile dosare i livelli di 25-OH vitamina D, è preferibile utilizzare due boli consecutivi per os da 300.000 UI ciascuno, preferenzialmente in inverno o in primavera, seguiti da una dose di mantenimento di colecalciferolo per os pari a 7000 UI ogni sette giorni. Ove possibile, è consigliabile ricontrollare i livelli di 25-OH vitamina D dopo sei mesi dalla supplementazione, ai fini di verificare il raggiungimento dei livelli ottimali (Figura 4). |
| |
 |
| |
Data l’importanza assoluta del calcio ai fini di una corretta mineralizzazione ossea, è indispensabile intervenire sulla dieta o, ove non possibile, integrare con sali di calcio in caso di un introito alimentare dello stesso inferiore a 1 gr/die.
Il calcolo dell’intake alimentare del calcio mediante i diversi questionari disponibili permette di ottimizzare la supplementazione dello stesso.
C) Il terzo e ultimo step, ai fini della corretta gestione del paziente a rischio elevato, è quello della corretta valutazione dell’opportunità di un intervento sul regime antiretrovirale in corso.
E’ importante sottolineare come la densità minerale ossea sia determinata per l’80% da fattori genetici, e solo per il 20% da fattori ambientali: uno di questi fattori ambientali è rappresentato dal virus e un altro dal danno iatrogeno da farmaci, di cui gli antiretrovirali (a loro volta) ne costituiscono un’ulteriore parte.
Prima di ogni considerazione in merito a questo punto occorre ricordare, se necessario, come la replicazione virale “per se” sia un fattore indipendente di perdita di densità minerale ossea e come questo effetto lesivo ecceda quello provocato dai diversi regimi antiretrovirali impiegati.
Nell’ottica di un contenimento della tossicità ossea della terapia antiretrovirale, la correzione dei principali fattori di rischio per perdita di densità minerale ossea assume pertanto sempre un ruolo fondamentale e prioritario rispetto ai possibili interventi mirati sulla terapia antiretrovirale.
E’ altresì vero che tutti i farmaci antiretrovirali, anche se in diversa misura, possono avere un loro impatto sul metabolismo osseo, specialmente nelle prime settimane/mesi di terapia.
La tossicità ossea di tenofovir e degli inibitori della proteasi eccede quella degli altri antiretrovirali, ma si estrinseca in particolare nei primi 12 mesi di terapia e specialmente nei soggetti pretrattati.
Indubbiamente, in caso di perdita progressiva di densità minerale ossea, dopo aver considerato tutte le cause di osteoporosi secondaria ed essere intervenuti su quelle modificabili e in presenza di alternative efficaci, è opportuno considerare la possibilità di un intervento sui singoli componenti del regime in uso.
Anche se non esistono dati definitivi sugli interventi di switch di terapia antiretrovirale nella prevenzione o nel trattamento della osteoporosi nei pazienti con infezione da HIV, dati preliminari indicano la possibile reversibilità, almeno parziale e in diversa misura, del danno osseo.
Questa reversibilità è dimostrata sia con interventi volti sul backbone, sia sul terzo farmaco, a dimostrazione che, il più delle volte, il fenotipo osteotossico che osserviamo è la conseguenza di un regime piuttosto che di una singola molecola. |
| |
|
Bibliografia
- Brown, T.T. and Qaqish R.B., Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review. AIDS, 2006. 20(17): p. 2165-74.
- Cazanave, C., et al., Reduced bone mineral density in HIV-infected patients: prevalence and associated factors. AIDS, 2008. 22(3): p. 395-402.
- Bischoff-Ferrari, H.A., et al., Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr, 2006. 84(1): p. 18-28.
- Mueller, N.J., et al., High prevalence of severe vitamin D deficiency in combined antiretroviral therapy-naive and successfully treated Swiss HIV patients. AIDS.
- Paccou, J., et al., Bone loss in patients with HIV infection. Joint Bone Spine, 2009. 76(6): p. 637-41.
- Borderi, M., et al., Metabolic bone disease in HIV infection. AIDS, 2009. 23(11): p. 1297-310.
- Tremollieres, F.A., et al., Fracture risk prediction using BMD and clinical risk factors in early postmenopausal women. Sensitivity of the who FRAX tool. J Bone Miner Res.
- Watts, N.B., et al., Filtering FRAX.Osteoporos Int. 21(4): p. 537-41.
- Jacobson, D.L., et al., Evolution and predictors of change in total bone mineral density over time in HIV-infected men and women in the nutrition for healthy living study. J Acquir Immune Defic Syndr, 2008. 49(3): p. 298-308.
- Brown, T.T. and QaqishR.B., Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review. AIDS, 2006. 20(17): p. 2165-74.
- Calmy, A., et al., Low bone mineral density, renal dysfunction, and fracture risk in HIV infection: a cross-sectional study. J Infect Dis, 2009. 200(11): p. 1746-54.
- Dawson-Hughes B, et al., (2008) Clinician’s guide to prevention and treatment of osteoporosis. National Osteoporosis Foundation. www.nof.org.
- Garnero, P., Biomarkers for Osteoporosis Management: Utility in Diagnosis, Fracture Risk Prediction and Therapy Monitoring. Molecular Diagnosis & Therapy: 1 May 2008 - Volume 12 - Issue 3 - pp 157-170.
- Torti, C. et al., High prevalence of radiological vertebral fractures in HIV-infected males. Endocrine (2012) 41:512–517.
- McComsey G.A. et al., Bone Disease in HIV Infection: A Practical Review and Recommendations for HIV Care Providers. Clinical Infectious Diseases 2010; 51(8):937– 946.
- Vescini F et al., Prevalence of hypovitaminosis D and factors associated with vitamin D deficiency and morbidity among HIV-infected patients enrolled in a large italian cohort. J Acquir Immune Defic Syndr 2011. 58: p. 163–172.
|
|
|