Al basale, i pazienti nel braccio EVG/COBI/TDF/FTC presentavano una mediana di HIV RNA di 4.88 log10copie/ml e una conta media di CD4 di 364 cellule/mmc. I pazienti in terapia con ATV/r + TDF/FTC avevano una mediana di HIV RNA pari a 4.86 log10 copie/ml e una conta media di CD4 di 375 cellule/mmc. Il 42% dei pazienti in EVG/COBI/TDF/FTC e il 40% di quelli in ATV/r + TDF/FTC avevano livelli di viremia superiori a 100.000 copie/ml. Il 15% dei pazienti in EVG/COBI/TDF/FTC e l’11% di quelli in ATV/r + TDF/FTC avevano conte di CD4 inferiori o uguali a 200 cellule/mmc.
A 48 settimane di terapia (6) EVG/COBI/TDF/FTC è risultato non inferiore a ATV/r + TDF/FTC (rispettivamente, il 90% vs l’87% dei pazienti avevano un HIV-RNA < 50 copie/ml, IC95% -1.9%-7.8%), il successo virologico si è mantenuto a 96 settimane (83% vs 82% , IC95% -4.5% - 6.7%) (13) ed è stato confermato alla settimana 144 di trattamento nei diversi sottogruppi di pazienti (stratificati per caratteristiche demografiche, livelli basali di viremia e di CD4) (Figure 10 e 11).
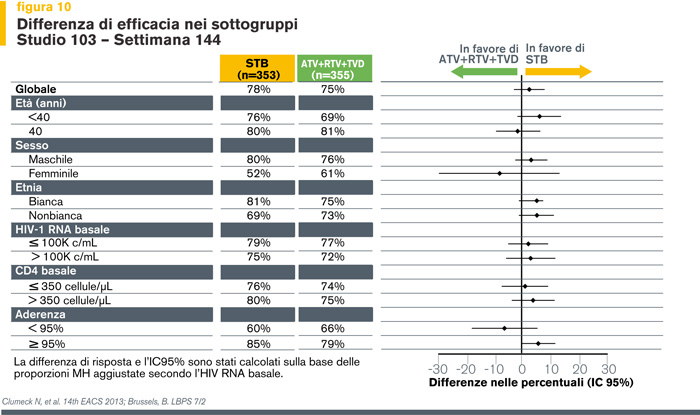
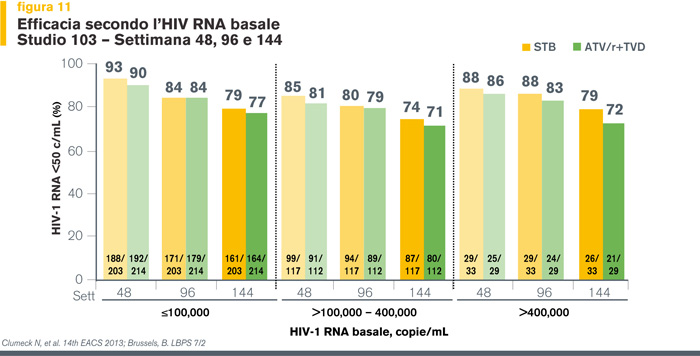
Di particolare rilevanza appare il dato secondo cui l’efficacia clinica di EVG/COBI/TDF/FTC è confermata anche nei pazienti con alte viremie basali (≥ 100.000 copie/ml e > 400.000 copie/ml).
Nel corso di tutto lo studio 103 si dimostra l’andamento favorevole nei pazienti trattati con EVG/COBI/TDF/FTC, come evidenziato all’analisi snapshot (Figura 4).

I pazienti nel gruppo EVG/COBI/TDF/FTC hanno mostrato un aumento medio di +280 CD4/mmc a 144 settimane di follow up, mentre quelli in ATV/r + TDF/FTC un aumento medio di 293 CD4/mmc.
I tassi di fallimento virologico sono stati pari all’8% per EVG/COBI/TDF/FTC e al 7% per ATV/r + TDF/FTC sulla base dell’analisi snapshot.
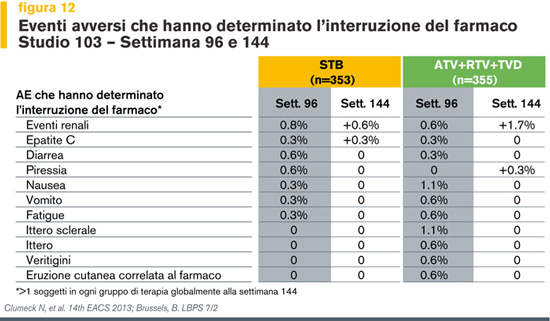
Nel corso delle 144 settimane, a causa di eventi avversi hanno interrotto il trattamento il 6% dei pazienti che ricevevano il nuovo STR e il 9% dei pazienti in ATV/r + TDF/FTC.
Gli eventi avversi che hanno comportato l’interruzione sono stati rispettivamente eventi riguardanti la funzionalità renale (1.4%), epatite C (0.6%) e depressione (0.6%), rialzo termico (0.6%), nausea (0.3%), vomito (0.3%) e facile stancabilità (0.3%). Nell’altro braccio di terapia gli eventi avversi che hanno determinato l’interruzione del trattamento sono invece stati eventi renali (2.3%), nausea (1.1%), ittero sclerale (1.1%), epatite C (0.3%), diarrea (0.3%) e rialzo termico (0.3%) (Figura 12).
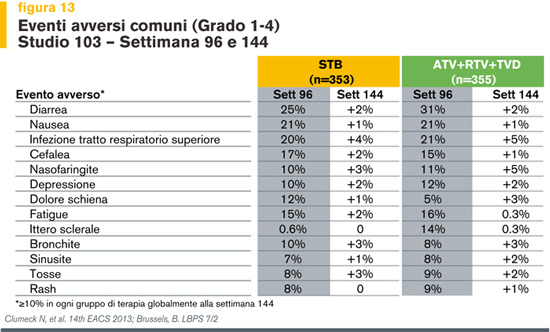
Altri eventi avversi comuni (in almeno il 10% dei pazienti in ogni braccio di terapia) sono stati diarrea, nausea e infezioni del tratto respiratorio superiore (Figura 13).
Con l’eccezione dell’iperbilirubinemia tra i pazienti in ATV/r + TDF/FTC, le alterazioni di grado 3-4 sono risultate simili per entrambi i regimi in studio.
Le variazioni medie dal basale di colesterolo totale, HDL e LDL a 144 settimane sono state simili per i due regimi e, rispettivamente, pari a +20, + 8 e +17 mg/dl per EVG/COBI/TDF/FTC e +16, +7 e +18 mg/dl per ATV/r + TDF/FTC (colesterolo totale p=0.30; HDL p=0.39, LDL p=0.98).
Le variazioni dal basale dei trigliceridi sono risultate rispettivamente pari a +15 mg/dl per il nuovo STR e a +22 mg/dl per ATV/r + TDF/FTC (p=0.24).
Entrambi i regimi hanno mostrato profili di safety renale simili, con aumento mediano dal basale a 144 settimane di trattamento di creatinina sierica di 0.12 mg/dl per EVG/COBI/TDF/FTC e di 0.08 mg/dl per ATV/r + TDF/FTC. Fino a 144 settimane, nessun paziente che assumeva il nuovo STR e 3 pazienti in ATV/r + TDF/FTC hanno interrotto il trattamento per sviluppo di tubulopatia renale prossimale. Tra la settimana 96 e 144 di terapia, un paziente in EVG/COBI/TDF/FTC e uno in ATV/r + TDF/FTC hanno interrotto il trattamento a causa di un rialzo isolato di creatinina senza manifestazioni di tubulopatia renale prossimale (Figura 14).

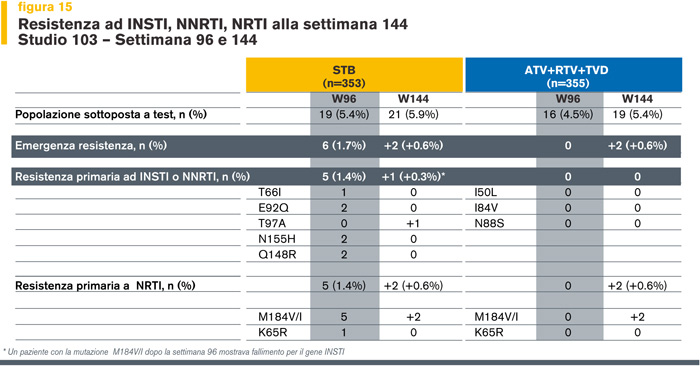
Mentre nei fallimenti virologici a 96 settimane si sono osservati 5 casi di mutazioni associati a resistenza per INSTI, si sono verificati solo due casi di resistenza in entrambi i bracci di terapia tra la settimana 96 e 144 (Figura 15).
|