|
| |
| Gli studi registrativi |
| |
Dopo 48 settimane di terapia nello studio ECHO, l’83% dei pazienti, in entrambi i regimi terapeutici, raggiungevano una viremia non rilevabile (<50 copie/mL) [differenza percentuale -0.1%, 95% intervallo di confidenza (95% CI) -5.5 5.7)]. Nell’analisi per protocol risultavano soppressi l’ 85% dei pazienti nel braccio rilpivirina e l’83% nel braccio efavirenz [differenza percentuale 0.8%, 95% CI -4.8 -6.5]; lo studio raggiungeva così l’end-point primario.
Analizzando ulteriormente i dati a disposizione, si è potuto notare che nei pazienti con viremia <100.000 copie/mL il tasso di risposta era del 90% nel braccio rilpivirina rispetto al solo 83% nel braccio efavirenz. In modo inaspettato, però, nei pazienti con > 500.000 HIV-RNA copie/mL, rilpivirina ha dimostrato un più basso tasso di risposta rispetto ad efavirenz (62 vs. 81%). Questo risultato è stato attribuito dagli autori dello studio, al ridotto numero di pazienti con viremie plasmatiche così elevate presenti nei due bracci di terapia (rilpivirina = 10% vs. efavirenz = 14%).
Infine, dopo la 48 settimana di terapia sono stati valutati i fallimenti virologici (HIV-RNA >50 copie/mL: questi si sono registrati nel 13% dei pazienti nel braccio rilpivirina, mentre erano il 6% nel braccio efavirenz. Al fallimento, in oltre la metà dei pazienti, erano visibili mutazioni al genotipo, le più comuni erano E138K nel braccio rilpivirina e la K103N nel braccio efavirenz. La mutazione M184I, V, o entrambe erano le più comuni appartenenti agli analoghi nucleos(t)idici nei due gruppi.
Per quanto riguarda gli eventi avversi di grado 2-4, sono stati registrati 55 eventi (16%) nel braccio rilpivirina vs 108 (31%) nel braccio efavirenz, (p<0.0001). Le successive discontinuazioni di terapia legate alla comparsa dell’evento avverso sono state 8 (2%) con rilpivirina vs 27 (8%) con efavirenz. I più comuni eventi avversi sono stati: rash, vertigini, incubi e sogni anormali.
Nello studio THRIVE sono stati screenati 947 pazienti, di questi 678 sono stati arruolati e randomizzati a rilpivirina oppure ad efavirenz (7). Il disegno era quindi molto simile allo studio ECHO, differenziandosi però nella scelta della coppia di nucleosidici. Nel THRIVE erano possibili tre diverse opzioni: emtricitabina/tenofovir DF, abacavir/lamivudina, oppure zidovudina/lamivudina. Dopo 48 settimane di osservazione l’86% dei pazienti nel braccio rilpivirina raggiungeva e confermava un HIV-RNA <50 copie/mL, contro l’82% del braccio efavirenz con ottenimento del criterio di non inferiorità del 12% (endpoint primario) con margine al 10% (p <0.0001).
Le discontinuazioni, prima della 48 settimana, sono state 106, equamente distribuite tra i due terzi farmaci. Per quanto riguarda gli eventi avversi ne sono stati registrati 15 nel braccio rilpivirina e 25 nel braccio efavirenz. Gli eventi classificati di grado tra 2 e 4 erano meno comuni con rilpivirina (16%), rispetto al braccio efavirenz (31%), p < 0.0001. Sono stati rilevati principalmente rash e vertigini (p<0.0001) ed incremento dei livelli ematici dei lipidi, più elevati con efavirenz rispetto a rilpivirina (p<0.0001).
Al contrario dello studio ECHO, nello studio THRIVE non si è rilevata la differenza di efficacia, statisticamente significativa, stratificando l’HIV-RNA in >/< 500.000 copie/mL, mentre è stato ottenuto nel braccio rilpivirina un maggiore incremento della conta dei CD4+ (189 vs 171 cellule/mmc, p =0.09). |
| |
| La pooled analysis a 96 settimane |
| Di recente sono stati presentati i dati relativi alla pooled analysis a 96 settimane degli studi ECHO e THRIVE (8, 9), che hanno dimostrato che rilpivirina, quando associata a tenofovir /emtricitabina non è inferiore ad efavirenz nel raggiungere l’end point primario di risposta virologica (HIV-RNA < 50 copie/ml) in pazienti adulti con infezione da HIV.
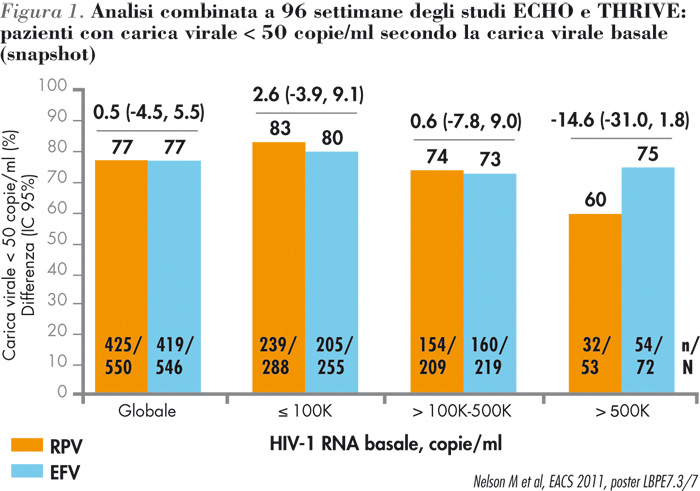
Rilpivirina + emtricitabina/tenofovir sulla popolazione globale mostra un’efficacia non-inferiore rispetto a efavirenz + emtricitabina/tenofovir a 96 settimane, con una risposta globale in ogni gruppo del 77% all’analisi snapshot (9). Nella popolazione in cui il farmaco è indicato (≤100.000 cp/ml) i tassi di risposta sono stati dell’83% per il gruppo rilpivirina+ emtricitabina/tenofovir e dell’80% per il gruppo efavirenz + emtricitabina/tenofovir. Tra le 100.000 e le 500.000 cp/ml i tassi di risposta sono stati simili (74% vs 73% rispettivamente) (Figura 1). |
| |
 |
| |
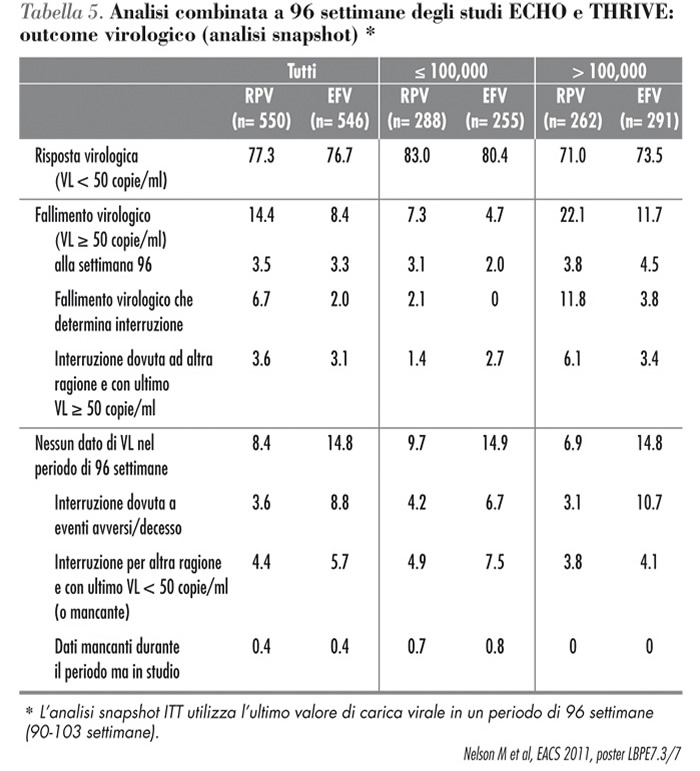
| La percentuale di fallimenti virologici durante il secondo anno (dalla settimana 48 alla settimana 96) è stata bassa e simile per il gruppo rilpivirina + emtricitabina/tenofovir e efavirenz + emtricitabina/tenofovir. In ambito di safety, rilpivirina ha mostrato di possedere un profilo globale di safey più favorevole, con meno interruzioni legate agli eventi avversi (Tabella 5). |
| |
 |
| |
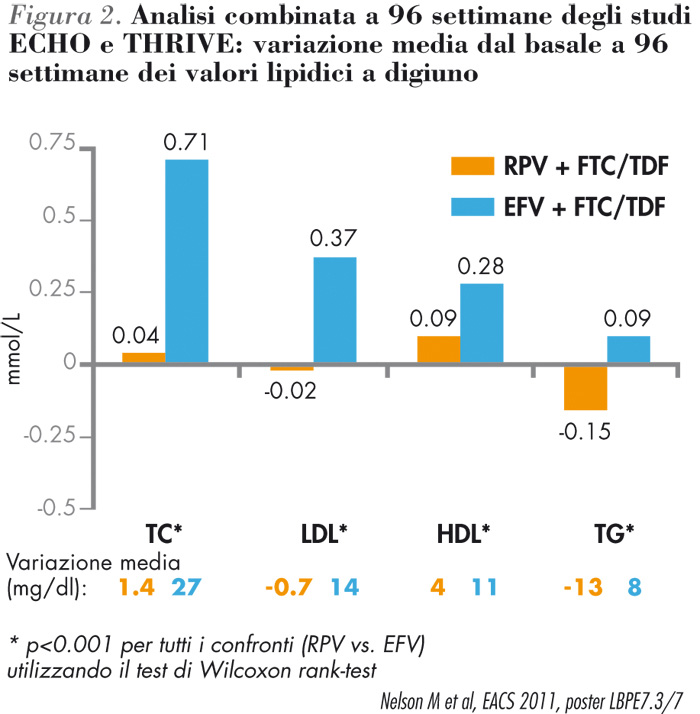
| Rilpivirina ha evidenziato tassi più bassi rispetto ad efavirenz di eventi avversi totali di grado 2-4, vertigini, sogni anormali/incubi e rash (di qualsiasi grado) e alterazioni lipidiche di grado 2-4 (Figura 2). |
| |
 |