| |
|
|
| |
| Studio PROGRESS: i risultati |
| |
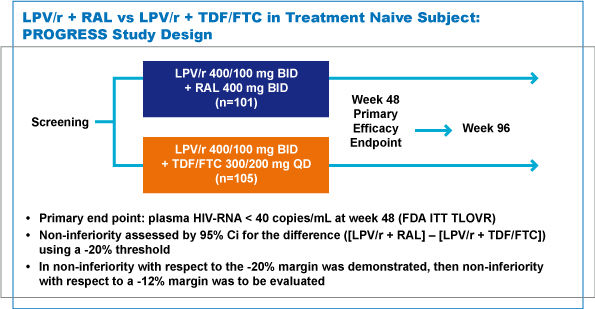
| Il regime terapeutico del primo braccio prevede un dosaggio di LPV/r di 400/100 mg BID associato a RAL 400 mg BID, mentre il secondo braccio si basa sul classico dosaggio della combinazione di LPV/r+TDF/FTC (figura 1). |
| |
| Figura 1 |
|
 |
| |
L'end-point primario è valutare l'efficacia in termini di proporzione di pazienti con HIV-RNA minore di 40 copie/ml (definita come undetectable) mediante l’analisi approvata dall’FDA ITT-TLOVR nei due diversi regimi a 48 e 96 settimane (utilizzando un test a più elevata sensibilità).
In particolare, la non inferiorità di LPV/r+RAL rispetto a LPV/r+TDF/FTC sarebbe stata confermata se il limite inferiore dell’intervallo di confidenza (IC) al 95% fosse risultato maggiore di –20%. Soddisfatta tale condizione, la non-inferiorità di LPV/r+RAL rispetto a LPV/r+TDF/FTC sarebbe stata ulteriormente confermata se il limite inferiore dell’IC al 95% fosse risultato maggiore di -12%.
Gli end-point secondari includono la valutazione della safety e della tolerability del regime e l'analisi degli effetti metabolici, della distribuzione del grasso corporeo, del tempo di perdita della risposta virologica, dell'incidenza di resistenze a ciascun farmaco e dei “patient-reported” outcomes. Le caratteristiche demografiche all'arruolamento non mostravano differenze significative tra i soggetti arruolati nei due bracci di studio. In entrambi i gruppi l'età media, la suddivisione per sesso del campione e l'assetto immuno-virologico non presentavano differenze significative (tabella 1). |
| |
| Tabella 1 |
|
| Caratteristiche all'arruolamento |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Media HIV-RNA
(log10 copie/ml) |
|
|
|
|
|
|
|
| |
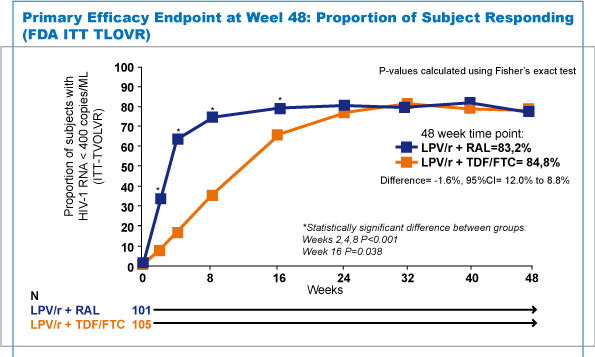
| L'analisi ad interim ha evidenziato un'efficacia virologica a 48 settimane sovrapponibile, infatti la proporzione di pazienti con livelli di viral load minore di 40 copie/ml (LPV/r + RAL 83,2% vs LPV/r+TDF/FTC 84,8%) non mostrava differenze statisticamente significative nel confronto tra i due gruppi dimostrando pertanto la non-inferiorità (difference=-1,6%, 95%CI=-12% to 8,8%) rispetto ad entrambi i limiti previsti dallo studio (-20% e -12%). Tuttavia va sottolineato come a 2, 4, 8 e 16 settimane il braccio con LPV/r+RAL mostrava, in modo statisticamente significativo, un numero maggiore di pazienti con carica virale undetectable (figura 2). |
| |
| Figura 2 |
|
 |
| |
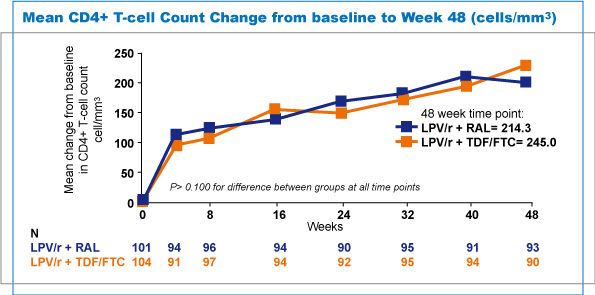
| Anche dal punto di vista dell’efficacia immunologica entrambi i gruppi di pazienti presentavano un recupero sovrapponibile dei CD4+. Inoltre ciascun gruppo mostrava un incremento statisticamente significativo del numero dei CD4+ rispetto a quello presente al proprio baseline (LPV/r+RAL +214,9 cell/mmc vs LPV/r+TDF/FTC +245 cell/mmc) (figura 3). |
| |
| Figura 3 |
|
 |
| |
| Valutando la percentuale complessiva di discontinuazione dei due regimi antiretrovirali, il regime NRTI-sparing veniva interrotto entro le 48 settimane nel 7,9% dei casi contro il 10,5% dei casi della terapia standard con PI+2NRTI, rappresentati prevalentemente da perdita al follow up (tabella 2). |
| |
| Tabella 2 |
|
Reasons
for discontinuations |
|
|
LPV/r + RAL
(N=101) n. (%) |
|
|
LPV/r + TDF/FTC
(N=105) n, (%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| On treatment beyond week 48 |
|
|
|
|
|
|
|
|
* P > 0.100 for LPV/r + RAL vs LPV/r + TDF/FTC comparison for each reason
† 4 subjects discontinued prior to week 48 and 4 subjects discontinued after week 48 visit
** 9 subjects discontinued prior to week 48 and 2 subjects discontinued after week 48 visit
§ 1 LPV/r + RAL subject discontinued due to two reasons: Noncompliance and Other |
|
|
|
| |
Tuttavia la safety e la tollerabilità dei due regimi in generale non presentavano differenze significative in termini di eventi avversi moderati/gravi (LPV/r+RAL 27,7% vs LPV/r+TDF/FTC 27,6%). Gli eventi avversi più comunemente riportati in entrambi i gruppi sono stati prevalentemente di pertinenza gastrointestinale.
Riguardo all'analisi del profilo metabolico, nel braccio LPV/r+RAL si sono osservati una percentuale maggiore di pazienti dislipidemici e livelli mediamente più alti di colesterolo totale e di trigliceridi rispetto al baseline associati a basso HDL tuttavia non si sono osservate differenze significative tra i due bracci relativamente ai rapporti TC/HDL e LDL/HDL. |
| |
| In relazione all'end-point secondario dello studio delle resistenze, nelle prime 48 settimane solo 4 soggetti in terapia con LPV/r+RAL e 3 in LPV/r+TDF/FTC avevano soddisfatto i criteri per effettuare un test di resistenza. L'analisi dell'emergenza di nuove mutazioni mostrava come in un solo paziente, nel braccio in terapia con LPV/r+RAL, era stata isolata la mutazione per RAL N155H. Allo stesso modo, nel braccio di confronto a 3 farmaci, era stata isolata in un solo caso la mutazione M184V per FTC. In entrambi i bracci non è stata evidenziata alcuna insorgenza di mutazione a carico del PI. |
| |
| Tabella 3 |
|
7 subjects (4 LPV/r + RAL and 3 LPV/r + TDF/FTC) met the protocol-defined criteria for resistance testing
-N155H mutation detected in 1 LPV/r + RAL subject
-M184V mutation detected in 1 LPV/r + TDF/FTC subject |
|
|
|
|
| Number of subjects with new mutations |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
LPV-associated mutations: major: V321, I47V/A, L76A, V82A/F/T/S. Minor: L10F/I/R/V, K20M/R, L24I, L33F, M46I/L, I50V, F53L, I54/V/L/A/M/T/S, L63P, A71V/T, G73S, I84V or L90M
RAL-associated mutatons: Y143R/H/C, Q148H/K/R or N155H
TDF- associated mutations: K65R or K70E
FTC- associated mutations: K65R or M184V/I
† 1 RAL sample not available for testing after meeting protocol-defined criteria
N/A – not applicable |
|
|
|
| |
| Sulla base dell'analisi dei risultati a 48 settimane, gli Autori dello studio PROGRESS suggeriscono pertanto che il regime NRTI-sparing a due farmaci LPV/r+RAL ha un'efficacia, una safety e una tollerabilità sovrapponibile a quella ottenuta dal regime di combinazione standard a 3 farmaci (PI+2NRTIs) in pazienti HIV positivi naive. In conclusione, i risultati dello studio PROGRESS, nell’analisi FDA ITT-TLOVR mostrano la non inferiorità del regime LPV/r+RAL rispetto al regime LPV/r+TDF/FTC dopo 48 settimane di trattamento. In particolare, nel braccio NRTI-sparing è stata evidenziata una maggiore e significativa efficacia virologica nelle prime settimane di trattamento dimostrando un più rapido decay virologico del regime LPV/r+RAL. |
|
|
|
|
|
|