| |
|
|
| |
| Intensificazione e reservoir virali |
| |
| Sono stati così disegnati una serie di studi di intensificazione volti a verificare se l’aggiunta di un altro farmaco a un regime già soppressivo fosse in grado di abbattere la replicazione residua. Benché il farmaco più utilizzato per questa strategia sia stato raltegravir, in alcuni studi sono stati impiegati anche l’enfuvirtide e gli inibitori del CCR5. I risultati preliminari di alcune di queste ricerche erano già stati presentati al CROI dello scorso anno, e in generale non sono stati positivi. Infatti, a conferma di quanto suggerito dagli studi patogenetici riguardo alla stabilità dei reservoir virali, nessun tipo di intensificazione è stato in grado di influenzare l’entità della replicazione residua. |
| |
| Quest’anno i risultati definitivi delle ricerche già presentate in passato e quelli di nuovi studi sono stati riportati nel corso di due sessioni: la prima intitolata New Insights into Retroviral Pathogenesis e la seconda Impact of Treatment Intensification on HIV Reservoirs and Immune Activation. |
| |
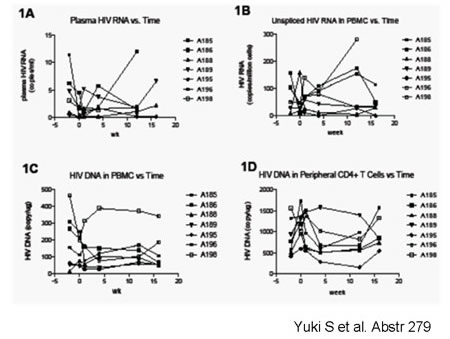
| In generale, tutti i dati presentati hanno confermato che l’aggiunta di raltegravir o maraviroc o enfuvirtide non ha modificato i valori di replicazione residua nel plasma, l’HIV DNA nei PBMC e l’HIV RNA cellulare a livello intestinale (Figura), mentre ha ridotto, in generale, i marcatori di immunoattivazione (Wiegand, abstract 280,
Yukl S, abstract 279; Gutierrez, abstract 284; De Laugerre, abstract 281). |
| |
 |
| |
| Secondo gli autori, questi risultati indicherebbero che la viremia residua misurabile nel plasma non deriva da una replicazione attiva, non essendo influenzata dai farmaci antiretrovirali. |
| |
| Diversa l’interpretazione fornita da J Martinez Picado a commento dello studio INTEGRAL (Buzon, abstract 100LB), un trial controllato condotto in 69 pazienti con HIV RNA < 50 copie/ml, metà dei quali sottoposti a un’intensificazione con raltegravir per 48 settimane. In questo gruppo non sono state osservate modificazioni significative della replicazione residua (misurata con il single genome assay) e dell’HIV DNA totale e integrato. Il 30% di essi ha presentato, però, un aumento transitorio dell’HIV DNA episomiale (2-LTR) non integrato, indicativo dell’attività antivirale del raltegravir; questi stessi pazienti presentavano al baseline livelli più alti dei marcatori di immunoattivazione, successivamente normalizzati dall’intensificazione con raltegravir. L’interpretazione degli autori, che è stata oggetto di un’ampia discussione, è che nel 30% dei pazienti con viremia inferiore a 50 copie esista comunque una replicazione attiva, documentata dall’aumento dei 2-LTR (che implica la presenza di virus infettante, nuovi round di infezione e trascrizione inversa). In questi pazienti il raltegravir sarebbe quindi in grado di produrre una “perturbazione” del reservoir virale. È evidente, quindi, che la chiave per sviluppare delle strategie vincenti consiste proprio nel chiarire l’origine della viremia residua: mentre gli antiretrovirali possono essere efficaci solo in presenza di una replicazione attiva, nuovi approcci sono necessari per aggredire la replicazione latente, in cui il provirus, complessato con la cromatina e incapace di produrre HIV RNA, potrebbe essere ipoteticamente “tirato fuori” con tecniche di “chromatin remodelling”, come affermato da F Maldarelli nel simposio che ha concluso il CROI: “The Future of HIV Therapeutic Research - The Treatment Agenda”. |
| |
| Infine, merita un accenno la strategia di intensificazione mirata a uno scopo diverso: aumentare i CD4 nei cosiddetti “discordanti immunologici”. Anche in questo caso, però, gli studi presentati non hanno potuto dimostrare la validità di questo approccio (Hatano, abstract 101LB; Wilkin, abstract 285). |
| |
 |
|
|
|
|
|
|